ЭПЛЕРЕНОН Ксиромед Фильмтабл 25 мг
EPLERENON Xiromed Filmtabl 25 mg
-
11004.71 RUB
При оплате криптовалютой:
Ваша прибыль 1100.47 RUB / 12.78 USDT
- Наличие: Нет в наличии
- Производитель: Xiromed SA
- Модель: 7809571
- ATC-код C03DA04
- EAN 7680682830015
Варианты
ЭПЛЕРЕНОН Ксиромед Фильмтабл 25 мг
11004.71 RUB
Описание
Was ist Eplerenon Xiromed und wann wird es angewendet?
Auf Verschreibung des Arztes oder der Ärztin.
Eplerenon Xiromed gehört zu einer Gruppe von Arzneimitteln, welche selektive Aldosteron-Antagonisten genannt werden. Aldosteron ist eine vom Körper produzierte Substanz, die an der Regulierung des Blutdruckes und der Herzfunktion beteiligt ist.
Eplerenon Xiromed wird in folgenden Fällen zur Behandlung Ihrer Herzmuskelschwäche angewendet, um so eine weitere Verschlechterung Ihrer Herzmuskelschwäche zu verhindern und mögliche Krankenhausaufenthalte zu reduzieren:
1. Falls Sie kürzlich einen Herzinfarkt hatten in Kombination mit anderen Arzneimitteln zur Behandlung einer Herzmuskelschwäche oder
2. falls Sie trotz der Behandlung, die Sie bisher erhalten haben, anhaltende leichte Symptome haben.
Wann darf Eplerenon Xiromed nicht eingenommen werden?
Eplerenon Xiromed darf nicht eingenommen werden:
- Wenn Sie auf den Wirkstoff Eplerenon oder einen Hilfsstoff von Eplerenon Xiromed Filmtabletten allergisch sind.
- Wenn Sie an einer Hyperkaliämie (erhöhte Kaliumwerte im Blut) leiden.
- Wenn Sie eine schwere Einschränkung der Nierenfunktion haben.
- Wenn Sie eine schwere Einschränkung der Leberfunktion haben.
- Wenn Sie kaliumsparende Diuretika (harntreibende Arzneimittel, z.B. mit dem Wirkstoff Spironolacton) oder Arzneimittel, die die Verstoffwechselung von Eplerenon Xiromed beeinträchtigen wie z.B. Itraconazol (Sporanox®), Ketoconazol (Nizoral®), Ritonavir (Norvir®), Nelfinavir (Viracept®) oder Clarithromycin (Klacid®) einnehmen.
- Wenn Sie an erhöhtem Blutdruck (Hypertonie) leiden und kaliumhaltige Präparate einnehmen oder kaliumhaltige Salzersatzprodukte verwenden.
- Wenn Sie bereits eine Kombination von Arzneimitteln zur Behandlung von gewissen Herzerkrankungen oder Bluthochdruck (sogenannte ACE-Hemmer und Angiotensinrezeptor-Blocker) einnehmen.
Wann ist bei der Einnahme von Eplerenon Xiromed Vorsicht geboten?
Besondere Vorsicht bei der Einnahme von Eplerenon Xiromed ist erforderlich, wenn einer der folgenden Umstände auf Sie zutrifft:
- Wenn Ihre Nieren- oder Leberfunktion eingeschränkt ist, wenn Sie zuckerkrank (Diabetiker) oder bereits älter sind. Ihr Arzt bzw. Ihre Ärztin wird dann Ihre Kaliumwerte regelmässig überprüfen.
- Wenn Sie Arzneimittel zur Behandlung von Herzerkrankungen einnehmen.
Bitte nehmen Sie Eplerenon Xiromed erst nach Rücksprache mit Ihrem Arzt bzw. Ihrer Ärztin ein, wenn Ihnen bekannt ist, dass Sie unter einer Zuckerunverträglichkeit leiden.
Eplerenon Xiromed Filmtabletten enthalten weniger als 1 mmol Natrium (23 mg) pro Tablette, d.h. sie sind nahezu «natriumfrei».
Die gleichzeitige Anwendung von Eplerenon Xiromed mit anderen Arzneimitteln wird von Ihrem Arzt bzw. Ihrer Ärztin beurteilt werden, um unerwünschte Wechselwirkungen möglichst zu verhindern.
Die gleichzeitige Einnahme von Lithium (z.B. Lithiofor®, Quilonorm®, Arzneimittel gegen manisch-depressive Erkrankungen), Ciclosporin (Sandimmun®) oder Tacrolimus (Prograf®) (Arzneimittel zur Beeinflussung des Immunsystems z.B. nach Organtransplantation) sollte vermieden werden.
Erythromycin (z.B. Erythrocin®, zur Behandlung von bakteriellen Infektionen), Saquinavir (Invirase®, eine antivirale Substanz, welche zur HIV-Behandlung eingesetzt wird), Amiodaron (Cordarone®, zur Behandlung von Herzrhythmusstörungen), Diltiazem (Dilzem®) und Verapamil (Isoptin®) (u.a. zur Behandlung von Herzrhythmusstörungen) sowie Fluconazol (Diflucan®, zur Behandlung von Pilzinfektionen) hemmen den Abbauweg von Eplerenon. In der Kombination sollte eine maximale Dosis von 25 mg Eplerenon (Eplerenon Xiromed) nicht überschritten werden.
Johanniskraut (pflanzliches Arzneimittel gegen depressive Verstimmung), Rifampicin (Rimactan®, zur Behandlung von bakteriellen Infektionen), Carbamazepin (z.B. Tegretol®), Phenytoin (Phenydan®) und Phenobarbital (z.B. Luminal®) (u.a. zur Behandlung von Krampfanfällen) können den Abbau von Eplerenon Xiromed beschleunigen und dadurch die Wirkung abschwächen. Eine gemeinsame Gabe mit Eplerenon Xiromed wird deshalb nicht empfohlen.
Vor der gleichzeitigen Behandlung von Antirheumatika (Arzneimittel gegen Schmerzen und Entzündung) und Eplerenon Xiromed muss die Nierenfunktion überprüft werden.
Die Anwendung bei Kindern und Jugendlichen wird nicht empfohlen.
Da während der Behandlung Schwindel oder Ohnmacht auftreten können, ist beim Autofahren oder Bedienen von Maschinen Vorsicht geboten bis Begleiterscheinungen der Behandlung bekannt sind.
Informieren Sie Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbst gekaufte!) einnehmen oder äusserlich anwenden.
Darf Eplerenon Xiromed während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Eplerenon Xiromed sollte während der Schwangerschaft nur auf ausdrückliche Anweisung des Arztes bzw. der Ärztin eingenommen werden. Eine Anwendung während der Stillzeit wird nicht empfohlen.
Informieren Sie Ihren Arzt bzw. Ihre Ärztin, wenn sie schwanger sind, es werden möchten oder wenn Sie stillen.
Wie verwenden Sie Eplerenon Xiromed?
Ihr Arzt bzw. Ihre Ärztin wird Sie über die korrekte Einnahme von Eplerenon Xiromed informieren.
Eplerenon Xiromed wird üblicherweise in Kombination mit einer Standardtherapie verschrieben. Die übliche Dosierung beträgt 50 mg einmal täglich, wobei die Behandlung mit 25 mg, einmal täglich, begonnen und die Dosierung dann langsam während vier Wochen auf 50 mg, einmal täglich, gesteigert wird. Die Filmtabletten können mit oder ohne Nahrung eingenommen werden. Nehmen Sie die Filmtabletten unzerkaut mit einem Glas Wasser ein.
Vor Beginn der Therapie mit Eplerenon Xiromed müssen Ihre Kaliumwerte im Blut überprüft werden. Danach müssen Ihre Kaliumwerte weiterhin kontrolliert werden, z.B. bei Dosisänderungen. Abhängig vom Ergebnis wird Ihr Arzt bzw. Ihre Ärztin die Dosierung von Eplerenon Xiromed eventuell verändern.
Wenn Sie zu viele Filmtabletten eingenommen haben
Falls Sie mehr Filmtabletten als verordnet eingenommen haben, konsultieren Sie sofort Ihren Arzt oder Apotheker resp. Ihre Ärztin oder Apothekerin.
Wenn Sie die Einnahme von Eplerenon Xiromed vergessen haben
Wenn Sie eine Filmtablette vergessen haben einzunehmen, holen Sie die vergessene Einnahme nicht nach. Nehmen Sie die nächste Filmtablette zum nächstfolgenden gewohnten Zeitpunkt ein.
Die Anwendung und Sicherheit von Eplerenon Xiromed bei Kindern und Jugendlichen ist bisher nicht geprüft worden.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Eplerenon Xiromed haben?
Folgende Nebenwirkungen können bei der Einnahme von Eplerenon Xiromed auftreten:
Häufig (betrifft 1 bis 10 von 100 Anwendern)
Infektion, erhöhte Kaliumwerte im Blut (mit möglichen Beschwerden wie Muskelkrämpfe, Durchfall, Übelkeit, Schwindel oder Kopfschmerzen), Flüssigkeitsverlust (Dehydrierung), Schwindel, Ohnmacht, Herzinfarkt, zu tiefer Blutdruck, Husten, Durchfall, Übelkeit, Verstopfung, Juckreiz, Muskelkrämpfe, Schmerzen des Bewegungsapparats, Nierenfunktionsstörungen und erhöhte Harnstoffwerte im Blut.
Gelegentlich (betrifft 1 bis 10 von 1000 Anwendern)
Nierenbeckenentzündung, Entzündung im Rachenbereich, Unterfunktion der Schilddrüse, erhöhte Blutfettwerte (Cholesterin oder Triglyceride), Schlaflosigkeit, Kopfschmerzen, Verminderung der Berührungs- und Drucksensibilität der Haut, Herzbeschwerden wie Herzrhythmusstörungen (Vorhofflimmern) und Herzschwäche (Linksherzinsuffizienz), Kreislaufstörungen beim Stehen, Thrombose der Beinarterien, Blähungen, Erbrechen, Gallenblasenentzündung, vermehrtes Schwitzen, Rückenschmerzen, Kraftlosigkeit, Unwohlsein, erhöhte Kreatininwerte im Blut (was auf Nierenprobleme hinweisen kann) und erhöhte Blutzuckerwerte.
Sehr selten (betrifft weniger als 1 von 10'000 Anwendern)
Ausschlag, Schwellungen insbesondere im Bereich des Kopfes mit Schwellung der Zunge, der Augenlider etc. (Angioödem) und Vergrösserung der Brustdrüsen (beim Mann).
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
Nicht über 30°C lagern. In der Originalverpackung aufbewahren. Ausser Reichweite von Kindern aufbewahren.
Weitere Hinweise
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Eplerenon Xiromed enthalten?
Wirkstoffe
Filmtablette zu 25 mg Eplerenon
1 Filmtablette enthält 25 mg Eplerenon.
Runde, weisse bis fast weisse Filmtabletten mit der Prägung «CG3» auf der einen Seite und ohne Prägung auf der anderen Seite.
Filmtablette zu 50 mg Eplerenon
1 Filmtablette enthält 50 mg Eplerenon.
Runde, weisse bis fast weisse Filmtabletten mit der Prägung «CG4» auf der einen Seite und ohne Prägung auf der anderen Seite.
Hilfsstoffe
Filmtablette zu 25 mg Eplerenon
Lactose-Monohydrat, mikrokristalline Cellulose (E460), Croscarmellose-Natrium (E468), Hypromellose (E464), Natriumdodecylsulfat (E487), Talk (E553b), Magnesiumstearat (E470b), Titandioxid (E171), Macrogol 4000 (E1521).
Filmtablette zu 50 mg Eplerenon
Lactose-Monohydrat, mikrokristalline Cellulose (E460), Croscarmellose-Natrium (E468), Hypromellose (E464), Natriumdodecylsulfat (E487), Talk (E553b), Magnesiumstearat (E470b), Titandioxid (E171), Macrogol 4000 (E1521).
Zulassungsnummer
68283 (Swissmedic).
Wo erhalten Sie Eplerenon Xiromed? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Eplerenon Xiromed 25 mg: Packungen zu 30 oder 100 Filmtabletten.
Eplerenon Xiromed 50 mg: Packungen zu 30 oder 100 Filmtabletten.
Zulassungsinhaberin
Xiromed SA, 6330 Cham.
Diese Packungsbeilage wurde im September 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu'est-ce que Éplérénone Xiromed et quand doit-il être utilisé?
Selon prescription du médecin.
Éplérénone Xiromed fait partie d'un groupe de médicaments appelés les inhibiteurs sélectifs de l'aldostérone. L'aldostérone est une substance produite par l'organisme; elle contribue à réguler la pression artérielle et à contrôler la fonction cardiaque.
Éplérénone Xiromed est utilisé dans les cas suivants pour le traitement de votre insuffisance cardiaque afin d'empêcher une nouvelle aggravation de votre insuffisance cardiaque et de réduire les éventuels séjours hospitaliers:
1. Si vous avez récemment souffert d'un infarctus du myocarde, en association avec d'autres médicaments pour le traitement de l'insuffisance cardiaque, ou
2. si vous avez des symptômes légers qui ont persisté malgré le traitement que vous avez reçu jusqu'à présent.
Quand Éplérénone Xiromed ne doit-il pas être pris?
Éplérénone Xiromed ne doit pas être pris:
- En cas d'allergie au principe actif, l'éplérénone, ou à l'un des excipients contenus dans les comprimés pelliculés d'Éplérénone Xiromed.
- Si vous souffrez d'une hyperkaliémie (taux de potassium élevé dans le sang).
- Si vous avez une limitation sévère de la fonction rénale.
- Si vous avez une limitation sévère de la fonction hépatique.
- Si vous prenez des diurétiques épargneurs de potassium (des médicaments qui augmentent la production d'urine et qui contiennent par ex. de la spironolactone comme principe actif) ou des médicaments qui interfèrent avec le métabolisme d'Éplérénone Xiromed tels que l'itraconazole (Sporanox®), le kétoconazole (Nizoral®), le ritonavir (Norvir®), le nelfinavir (Viracept®) ou la clarithromycine (Klacid®).
- Si vous souffrez d'hypertension artérielle et prenez des préparations ou des sels de régime contenant du potassium.
- Si vous prenez déjà une association de médicaments destinés au traitement de certaines affections cardiaques ou de l'hypertension artérielle (médicaments appelés inhibiteurs de l'ECA et antagonistes des récepteurs de l'angiotensine).
Quelles sont les précautions à observer lors de la prise d'Éplérénone Xiromed?
La prise d'Éplérénone Xiromed exige des précautions particulières si l'un des critères suivants vous concerne:
- Si vous souffrez d'une limitation de la fonction rénale ou hépatique, si vous êtes diabétique ou si vous avez déjà un certain âge. Votre médecin contrôlera régulièrement votre taux sanguin de potassium.
- Si vous prenez des médicaments pour le traitement d'une affection cardiaque.
Si votre médecin vous a informé d'une intolérance à certains sucres, contactez-le avant de prendre les comprimés pelliculés d'Éplérenone Xiromed.
Les comprimés pelliculés d'Éplérénone contiennent moins de 1 mmol (23 mg) de sodium par comprimé, c.-à-d. qu'ils sont essentiellement «sans sodium».
L'utilisation simultanée d'Éplérénone Xiromed et d'autres médicaments sera évaluée par votre médecin afin d'éviter autant que possible des interactions indésirables.
La prise simultanée de lithium (par ex. Lithiofor®, Quilonorm®, médicaments contre les maladies maniaco-dépressives), de ciclosporine (Sandimmun®) ou de tacrolimus (Prograf®) (médicaments qui influencent la réponse immunitaire, par ex. après une transplantation d'organes) doit être évitée.
L'érythromycine (par ex. Erythrocin®, pour traiter les infections bactériennes), le saquinavir (Invirase®, une substance antivirale utilisée dans le traitement contre le VIH), l'amiodarone (Cordarone®, pour traiter les troubles du rythme cardiaque), le diltiazem (Dilzem®) et le vérapamil (Isoptin®) (entre autres pour traiter les troubles du rythme cardiaque) ainsi que le fluconazole (Diflucan®, pour traiter les mycoses) inhibent la dégradation de l'éplérénone. En association, la dose maximale de 25 mg d'éplérénone (Éplérénone Xiromed) ne doit pas être dépassée.
Le millepertuis (médicament phytothérapeutique contre les états dépressifs), la rifampicine (Rimactan®, pour traiter les infections bactériennes), la carbamazépine (par ex. Tegretol®), la phénytoïne (Phenydan®) et le phénobarbital (par ex. Luminal®) (entre autres utilisés pour traiter les crises convulsives) peuvent accélérer la dégradation d'Éplérénone Xiromed, diminuant ainsi son effet. En conséquence, une administration concomitante d'Éplérénone Xiromed n'est pas recommandée.
La fonction rénale doit être contrôlée avant un traitement simultané par des anti-inflammatoires (médicaments contre les douleurs et les inflammations) et par Éplérénone Xiromed.
L'utilisation n'est pas recommandée chez les enfants et les adolescents.
Des vertiges ou des évanouissements peuvent survenir pendant le traitement. La prudence est donc de rigueur lors de la conduite ou de l'utilisation de machines, jusqu'à ce que les effets secondaires du traitement soient connus.
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie
- vous êtes allergique
- vous prenez déjà d'autres médicaments ou utilisez déjà d'autres médicaments en usage externe (même en automédication!).
Éplérénone Xiromed peut-il être pris pendant la grossesse ou l'allaitement?
Pendant la grossesse, Éplérénone Xiromed doit être pris uniquement sur prescription formelle du médecin. L'administration est déconseillée pendant l'allaitement.
Informez votre médecin si vous êtes enceinte, si vous envisagez une grossesse ou si vous allaitez.
Comment utiliser Éplérénone Xiromed?
Votre médecin vous fournira les informations nécessaires concernant la prise correcte d'Éplérénone Xiromed.
Éplérénone Xiromed est habituellement prescrit en association avec un traitement standard. La dose usuelle est de 50 mg une fois par jour, le traitement commençant avec une dose unique journalière de 25 mg qui sera progressivement augmentée jusqu'à 50 mg une fois par jour sur quatre semaines. Les comprimés pelliculés peuvent être pris avec ou sans aliments. Avalez les comprimés pelliculés avec un verre d'eau, sans les mâcher.
Votre taux sérique de potassium doit être contrôlé avant le début du traitement par Éplérénone Xiromed. Ensuite, votre taux de potassium devra encore être contrôlé, par ex. lors d'un changement de la posologie. En fonction du résultat, votre médecin modifiera éventuellement le dosage d'Éplérénone Xiromed.
Si vous avez pris trop de comprimés pelliculés
Si vous avez pris plus de comprimés pelliculés que prescrit, contactez immédiatement votre médecin ou votre pharmacien.
Si vous avez oublié de prendre Éplérénone Xiromed
Si vous avez oublié de prendre un comprimé pelliculé, ne rattrapez pas la dose oubliée. Prenez le prochain comprimé pelliculé à l'heure habituelle.
L'utilisation et la sécurité d'Éplérénone Xiromed n'ont pas été établies à ce jour pour les enfants et les adolescents.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Éplérénone Xiromed peut-il provoquer?
Les effets secondaires suivants peuvent survenir lors de la prise d'Éplérénone Xiromed:
Fréquent (concerne 1 à 10 utilisateurs sur 100)
Infection, augmentation du potassium dans le sang (avec des troubles possibles tels que crampes musculaires, diarrhée, nausées, vertiges ou céphalées), pertes liquidiennes (déshydratation), vertiges, évanouissements, infarctus du myocarde, pression sanguine trop basse, toux, diarrhée, nausées, constipation, démangeaisons, crampes musculaires, douleurs de l'appareil locomoteur, troubles de la fonction rénale et augmentation de l'urée dans le sang.
Occasionnel (concerne 1 à 10 utilisateurs sur 1'000)
Inflammation du bassinet rénal, inflammation dans la gorge, hypothyroïdie, élévation des taux de lipides dans le sang (cholestérol ou triglycérides), insomnie, maux de tête, diminution de la sensibilité de la peau au toucher et à la pression, troubles cardiaques tels que troubles du rythme cardiaque (fibrillation auriculaire) et insuffisance cardiaque (insuffisance ventriculaire gauche), troubles circulatoires en position debout, thromboses des artères des jambes, ballonnements, vomissement, inflammation de la vésicule biliaire, sudation accrue, douleurs dorsales, asthénie, malaise, augmentation de la créatinine dans le sang (ce qui peut indiquer un problème rénal) et augmentation du taux de glycémie.
Très rare (concerne moins d'un utilisateur sur 10'000)
Éruption cutanée, tuméfactions en particulier au niveau de la tête avec gonflement de la langue, des paupières, etc. (angioœdème) et augmentation du volume des glandes mammaires (chez l'homme).
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
À quoi faut-il encore faire attention?
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Ne pas conserver au-dessus de 30°C. Conserver dans l'emballage d'origine. Conserver hors de portée des enfants.
Remarques complémentaires
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Éplérénone Xiromed?
Principes actifs
Comprimés pelliculés à 25 mg d'éplérénone
1 comprimé pelliculé contient 25 mg d'éplérénone.
Comprimés pelliculés ronds, de couleur blanche à blanc cassé avec l'inscription «CG3» gravée sur une face et sans inscription sur l'autre face.
Comprimés pelliculés à 50 mg d'éplérénone
1 comprimé pelliculé contient 50 mg d'éplérénone.
Comprimés pelliculés ronds, de couleur blanche à blanc cassé avec l'inscription «CG4» gravée sur une face et sans inscription sur l'autre face.
Excipients
Comprimés pelliculés à 25 mg d'éplérénone
Lactose monohydraté, cellulose microcristalline (E460), croscarmellose sodique (E468), hypromellose (E464), laurilsulfate de sodium (E487), talc (E553b), stéarate de magnésium (E470b), dioxyde de titane (E171), macrogol 4000 (E1521).
Comprimés pelliculés à 50 mg d'éplérénone
Lactose monohydraté, cellulose microcristalline (E460), croscarmellose sodique (E468), hypromellose (E464), laurilsulfate de sodium (E487), talc (E553b), stéarate de magnésium (E470b), dioxyde de titane (E171), macrogol 4000 (E1521).
Numéro d'autorisation
68283 (Swissmedic).
Où obtenez-vous Éplérénone Xiromed? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Éplérénone Xiromed 25 mg: emballages de 30 ou 100 comprimés pelliculés.
Éplérénone Xiromed 50 mg: emballages de 30 ou 100 comprimés pelliculés.
Titulaire de l'autorisation
Xiromed SA, 6330 Cham.
Cette notice d'emballage a été vérifiée pour la dernière fois en septembre 2020 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos'è Eplerenone Xiromed e quando si usa?
Su prescrizione medica.
Eplerenone Xiromed fa parte di un gruppo di farmaci detti antagonisti selettivi dell'aldosterone. L'aldosterone è una sostanza prodotta dall'organismo che è coinvolta nella regolazione della pressione arteriosa e della funzionalità cardiaca.
Nei seguenti casi Eplerenone Xiromed è usato per il trattamento dell'insufficienza cardiaca, al fine di prevenire un ulteriore aggravamento dell'insufficienza cardiaca e di ridurre possibili ricoveri ospedalieri:
1. Se ha avuto recentemente un infarto miocardico, in combinazione con altri medicamenti per il trattamento dell'insufficienza cardiaca o
2. se, nonostante la terapia che ha ricevuto finora, continua a presentare lievi sintomi persistenti.
Quando non si può assumere Eplerenone Xiromed?
Eplerenone Xiromed non deve essere assunto:
- In caso d'allergia al principio attivo eplerenone o a una delle sostanze ausiliarie di Eplerenone Xiromed compresse rivestite con film.
- Se soffre di iperkaliemia (aumento dei livelli di potassio nel sangue).
- In caso di grave riduzione della funzionalità renale.
- In caso di grave riduzione della funzionalità epatica.
- Se assume diuretici risparmiatori di potassio (medicamenti che aumentano la produzione d'urina, ad es. contenenti il principio attivo spironolattone) o medicamenti che interferiscono con il metabolismo di Eplerenone Xiromed, come ad es. itraconazolo (Sporanox®), ketoconazolo (Nizoral®), ritonavir (Norvir®), nelfinavir (Viracept®) o claritromicina (Klacid®).
- Se soffre di pressione alta (ipertensione) e assume preparati contenenti potassio o utilizza sostituti del sale contenenti potassio.
- Se assume già una combinazione di medicamenti per il trattamento di determinate malattie cardiache o dell'ipertensione (i cosiddetti ACE-inibitori e gli antagonisti del recettore dell'angiotensina).
Quando è richiesta prudenza nella somministrazione di Eplerenone Xiromed?
L'assunzione di Eplerenone Xiromed richiede particolare cautela nelle seguenti circostanze:
- Se la sua funzionalità renale o epatica è ridotta, se soffre di diabete o se è anziano. In questi casi, il suo medico controllerà regolarmente i suoi livelli di potassio.
- Se assume medicamenti per il trattamento di malattie cardiache.
Se il medico le ha diagnosticato una intolleranza ad alcuni zuccheri, lo contatti prima di prendere Eplerenone Xiromed compresse rivestite con film.
Eplerenone Xiromed compresse rivestite con film contiene meno di 1 mmol (23 mg) di sodio per compressa, cioè essenzialmente «senza sodio».
L'uso concomitante di Eplerenone Xiromed con altri medicamenti sarà valutato dal suo medico per evitare il più possibile interazioni indesiderate.
L'assunzione concomitante di litio (ad es. Lithiofor®, Quilonorm®, medicamenti contro le malattie maniaco-depressive), ciclosporina (Sandimmun®) o tacrolimus (Prograf®) (medicamenti che influenzano il sistema immunitario, ad es. dopo il trapianto di organi) deve essere evitata.
L'eritromicina (ad es. Erythrocin®, per il trattamento di infezioni batteriche), saquinavir (Invirase®, una sostanza antivirale usata per il trattamento dell'HIV), amiodarone (Cordarone®, per il trattamento dei disturbi del ritmo cardiaco), diltiazem (Dilzem®) e verapamil (Ispotin®) (usati tra l'altro per il trattamento dei disturbi del ritmo cardiaco), come pure il fluconazolo (Diflucan®, per il trattamento di infezioni micotiche) inibiscono le vie di degradazione dell'eplerenone. Se usati in combinazione, non si deve superare una dose massima di 25 mg di eplerenone (Eplerenone Xiromed).
L'erba di San Giovanni (medicamento fitoterapeutico contro gli stati depressivi), la rifampicina (Rimactan®, per il trattamento delle infezioni batteriche), la carbamazepina (ad es. Tegretol®), la fenitoina (Phenydan®) e il fenobarbital (ad es. Luminal®) (usati tra l'altro per il trattamento delle crisi convulsive) possono accelerare la degradazione di Eplerenone Xiromed e attenuarne l'effetto. Pertanto, la somministrazione concomitante con Eplerenone Xiromed non è consigliata.
Prima di iniziare un trattamento concomitante con antinfiammatori (medicamenti contro il dolore e l'infiammazione) e Eplerenone Xiromed occorre controllare la funzionalità renale.
L'uso nei bambini e negli adolescenti non è consigliato.
Durante il trattamento possono comparire vertigini o svenimenti; pertanto, finché non si conoscono gli effetti collaterali del trattamento, si raccomanda cautela durante la guida di veicoli o l'utilizzo di macchine.
Informi il suo medico o il suo farmacista, nel caso in cui
- soffre di altre malattie,
- soffre di allergie o
- assume altri medicamenti (anche se acquistati di sua iniziativa) o li applica esternamente.
Si può assumere Eplerenone Xiromed durante la gravidanza o l'allattamento?
Eperenone Xiromed può essere assunto durante la gravidanza solo su esplicita indicazione del medico. L'uso durante l'allattamento non è consigliato.
Informi il suo medico se è incinta, se sta programmando una gravidanza o se sta allattando.
Come usare Eplerenone Xiromed?
Il suo medico le darà informazioni per la corretta assunzione di Eplerenone Xiromed.
Eplerenone Xiromed solitamente viene prescritto in combinazione con una terapia standard. La posologia abituale è di 50 mg una volta al giorno, iniziando il trattamento con 25 mg una volta al giorno e aumentando la dose lentamente a 50 mg una volta al giorno nel giro di quattro settimane. Le compresse rivestite con film possono essere assunte con o senza cibo. Assuma le compresse rivestite con film senza masticarle con un bicchiere d'acqua.
I suoi livelli di potassio nel siero devono essere controllati prima di iniziare la terapia con Eplerenone Xiromed. Anche in seguito i suoi livelli di potassio dovranno continuare ad essere controllati, ad es. dopo una modifica della dose. A seconda del risultato, il suo medico potrà cambiare la posologia di Eplerenone Xiromed.
Se ha assunto un numero eccessivo di compresse rivestite con film
Se ha assunto più compresse rivestite con film di quanto prescritto, consulti subito il suo medico o il suo farmacista.
Se ha dimenticato di assumere Eplerenone Xiromed
Se ha dimenticato di assumere una compressa rivestita con film, non compensi la dimenticanza. Assuma la compressa rivestita con film successiva all'orario abituale.
L'uso e la sicurezza di Eplerenone Xiromed nei bambini e negli adolescenti finora non sono stati esaminati.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere Eplerenone Xiromed?
In seguito all'assunzione di Eplerenone Xiromed possono manifestarsi i seguenti effetti collaterali:
Comune (riguarda da 1 a 10 utilizzatori su 100)
Infezione, livelli elevati di potassio nel sangue (con possibili disturbi come crampi muscolari, diarrea, nausea, vertigini o mal di testa), perdita di liquidi (disidratazione), vertigini, svenimento, infarto miocardico, pressione arteriosa troppo bassa, tosse, diarrea, nausea, stitichezza, prurito, crampi muscolari, dolori all'apparato locomotorio, disturbi della funzionalità renale e livelli elevati di urea nel sangue.
Non comune (riguarda da 1 a 10 utilizzatori su 1000)
Infiammazione della pelvi renale, infiammazione della gola, ipotiroidismo, livelli elevati di grassi nel sangue (colesterolo o trigliceridi), insonnia, mal di testa, riduzione della sensibilità della pelle al tatto e alla pressione, problemi cardiaci come disturbi del ritmo cardiaco (fibrillazione atriale) e insufficienza cardiaca (insufficienza ventricolare sinistra), disturbi circolatori da ortostatismo, trombosi delle arterie delle gambe, meteorismo, vomito, infiammazione della colecisti, sudorazione eccessiva, dolore alla schiena, mancanza di forze, malessere, livelli elevati di creatinina nel sangue (che possono essere indice di problemi renali) e livelli elevati di zucchero nel sangue.
Molto raro (riguarda meno di 1 utilizzatore su 10'000)
Eruzione cutanea, gonfiore, in particolare nella regione della testa con gonfiore della lingua, delle palpebre ecc. (angioedema) e ingrossamento delle ghiandole mammarie (negli uomini).
Se osserva effetti collaterali, si rivolga al suo medico o farmacista soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Stabilità
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Istruzioni di conservazione
Non conservare a temperature superiori a 30°C. Conservare nella confezione originale.
Conservare fuori dalla portata dei bambini.
Ulteriori indicazioni
Il medico, il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Eplerenone Xiromed?
Principi attivi
Compressa rivestita con film da 25 mg di eplerenone
1 compressa rivestita con film contiene 25 mg di eplerenone.
Compresse rivestite con film rotonde, di colore da bianco a biancastro con «CG3» impresso su un lato e lisce sull'altro lato.
Compressa rivestita con film da 50 mg di eplerenone
1 compressa rivestita con film contiene 50 mg di eplerenone.
Compresse rivestite con film rotonde, di colore da bianco a biancastro con «CG4» impresso su un lato e lisce sull'altro lato.
Sostanze ausiliarie
Compressa rivestita con film da 25 mg di eplerenone
Lattosio monoidrato, cellulosa microcristallina (E460), croscarmellosa sodica (E468), ipromellosa (E464), sodio lauril solfato (E487), talco (E553b), magnesio stearato (E470b), titanio diossido (E171), macrogol 4000 (E1521).
Compressa rivestita con film da 50 mg di eplerenone
Lattosio monoidrato, cellulosa microcristallina (E460), croscarmellosa sodica (E468), ipromellosa (E464), sodio lauril solfato (E487), talco (E553b), magnesio stearato (E470b), titanio diossido (E171), macrogol 4000 (E1521).
Numero dell'omologazione
68283 (Swissmedic).
Dove è ottenibile Eplerenone Xiromed? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Eplerenone Xiromed 25 mg: confezioni da 30 o 100 compresse rivestite con film.
Eplerenone Xiromed 50 mg: confezioni da 30 o 100 compresse rivestite con film.
Titolare dell'omologazione
Xiromed SA, 6330 Cham.
Questo foglietto illustrativo è stato controllato l'ultima volta nel settembre 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoffe
Eplerenonum.
Hilfsstoffe
Filmtablette zu 25 mg Eplerenon: Lactosum monohydricum (36.92 mg), cellulosum microcristallinum (E460), carmellosum natricum conexum (E468), hypromellosum (E464), natrii laurilsulfas (E487), talcum (E553b), magnesii stearas (E470b), titanii dioxidum (E171), macrogolum 4000 (E1521).
Eine 25 mg Filmtablette enthält 36.92 mg Lactose und 0.43 mg Natrium.
Filmtablette zu 50 mg Eplerenon: Lactosum monohydricum (73.85 mg), cellulosum microcristallinum (E460), carmellosum natricum conexum (E468), hypromellosum (E464), natrii laurilsulfas (E487), talcum (E553b), magnesii stearas (E470b), titanii dioxidum (E171), macrogolum 4000 (E1521).
Eine 50 mg Filmtablette enthält 73.85 mg Lactose und 0.86 mg Natrium.
Darreichungsform und Wirkstoffmenge pro Einheit
Filmtablette.
Filmtabletten zu 25 mg: 1 Filmtablette enthält 25 mg Eplerenon.
Runde, weisse bis fast weisse Filmtabletten mit der Prägung «CG3» auf der einen Seite und ohne Prägung auf der anderen Seite.
Filmtabletten zu 50 mg: 1 Filmtablette enthält 50 mg Eplerenon.
Runde, weisse bis fast weisse Filmtabletten mit der Prägung «CG4» auf der einen Seite und ohne Prägung auf der anderen Seite.
Indikationen/Anwendungsmöglichkeiten
Eplerenon ist indiziert:
- zusätzlich zu einer Standardtherapie, welche Betablocker einschliesst, zur Verringerung des Risikos der kardiovaskulären Mortalität und Morbidität bei stabilen Patienten mit linksventrikulärer Dysfunktion (LVEF ≤40%) und klinischen Zeichen einer Herzinsuffizienz nach kürzlich aufgetretenem Myokardinfarkt;
- zusätzlich zu einer optimalen Standardtherapie zur Verringerung des Risikos kardiovaskulär bedingter Mortalität und Morbidität bei Patienten mit (chronischer) Herzinsuffizienz der NYHA-Klasse II und linksventrikulärer systolischer Dysfunktion (LVEF ≤30%) (siehe «Eigenschaften/Wirkungen»).
Dosierung/Anwendung
Eplerenon kann unabhängig von den Mahlzeiten eingenommen werden. Zur individuellen Dosisanpassung stehen die Dosierungen 25 mg und 50 mg zur Verfügung, die Einnahme erfolgt einmal täglich. Die Tageshöchstdosis kann 25 mg oder 50 mg betragen (siehe «Spezielle Dosierungsanweisungen»).
Übliche Dosierung
Bei Patienten mit einem Serumkaliumwert über 5.0 mmol/l oder einer eGFR <30 ml/min/1.73 m2 darf keine Behandlung mit Eplerenon begonnen werden (siehe «Kontraindikationen»).
Die Serumkaliumwerte müssen vor Beginn der Therapie mit Eplerenon, innerhalb der ersten Behandlungswoche, des ersten Monats nach Therapiebeginn sowie jeweils nach einer Dosisanpassung bestimmt werden. Danach müssen die Kaliumwerte je nach Bedarf in regelmässigen Abständen kontrolliert werden. Dies gilt vor allem für ältere Patienten, Patienten mit Diabetes mellitus und Patienten mit eingeschränkter Nierenfunktion.
Die Dosierung von Eplerenon muss jeweils in Abhängigkeit des Serum-Kaliums überprüft werden (siehe Tabelle 1).
Übliche Dosierung bei Patienten mit einer eGFR ≥50 ml/min/1.73 m2
Patienten mit Herzinsuffizienz der Klasse NYHA II sowie Patienten mit Herzinsuffizienz nach Myokardinfarkt, welche Serum-Kalium von ≤5 mmol/l aufweisen, sollen eine Anfangsdosis von 25 mg, verabreicht 1x täglich, erhalten. In Abhängigkeit des Serum-Kaliums (siehe Tabelle 1) soll die Dosis innerhalb von 4 Wochen nach Therapiebeginn auf die Zieldosis von 50 mg, verabreicht 1x täglich, erhöht werden.
Die maximale Dosis für diese Patienten beträgt 50 mg/Tag.
Bei Patienten nach Myokardinfarkt sollte die Therapie 3-14 Tage nach dem Ereignis begonnen werden.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Bei Patienten mit leichter bis mittelstarker Leberinsuffizienz ist keine Anpassung der Anfangsdosis erforderlich. Da es jedoch bei Patienten mit leichter bis mittelstarker Leberinsuffizienz zu einer erhöhten systemischen Wirkstoffbelastung mit Eplerenon kommt, wird eine häufige und regelmässige Kontrolle der Serumkaliumwerte empfohlen, insbesondere bei älteren Patienten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Anwendung von Eplerenon bei Patienten mit schwerer Leberinsuffizienz (Child-Pugh C) ist kontraindiziert (siehe «Kontraindikationen»).
Tabelle 1: Dosisanpassung nach Behandlungsbeginn
Serumkaliumwerte (mmol/l) | Änderung der Dosierung | Dosisanpassung |
<5.0 | Erhöhung | Von Behandlungspause auf 25 mg jeden 2. Tag. Von 25 mg jeden 2. Tag auf 25 mg 1x täglich. Von 25 mg einmal täglich auf 50 mg 1x täglich, ausser bei: Patienten mit einer eGFR von 30-49 ml/min/1.73 m2 Patienten, welche einen schwachen bis mittelstarken CYP3A4-Inhibitor einnehmen. |
5.0–5.4 | Keine | Keine Veränderung. |
5.5–5.9 | Verringerung | Von 50 mg 1x täglich auf 25 mg 1x täglich. Von 25 mg 1x täglich auf 25 mg jeden 2. Tag. Von 25 mg jeden 2. Tag auf Behandlungspause. |
≥6.0 | Behandlungspause | Mit 25 mg jeden 2. Tag wieder beginnen, wenn Kalium <5.0 mmol/l. |
Patienten mit Nierenfunktionsstörungen
Patienten mit mittelstarker Niereninsuffizienz (eGFR zwischen 30 und 49 ml/min/1.73 m2)
Patienten mit Herzinsuffizienz der Klasse NYHA II, welche ein Serum-Kalium von von ≤5 mmol/l aufweisen, sollen eine Anfangsdosis von 25 mg jeden 2. Tag erhalten. Diese soll innerhalb von 4 Wochen nach Therapiebeginn auf die Zieldosis von 25 mg/Tag erhöht werden, in Abhängigkeit des Serum-Kaliums (siehe Tabelle 1). Die maximale Dosis beträgt 25 mg/Tag.
Für Patienten mit Herzinsuffizienz nach Myokardinfarkt und einer Kreatininclearance von <50 ml/min liegen keine Erfahrungen vor. Die Anwendung von Eplerenon bei diesen Patienten sollte mit Vorsicht erfolgen.
Patienten mit schwerer Niereninsuffizienz (eGFR <30 ml/min/1.73 m2)
Für diese Patienten ist die Anwendung von Eplerenon kontraindiziert.
Eplerenon ist nicht dialysierbar.
Ältere Patienten
In Studie EMPHASIS-HF wurden n=330 Patienten ≥75 Jahre mit Eplerenon behandelt. Die Behandlungsdosis richtete sich hierbei nach der Nierenfunktion (siehe «Eigenschaften/Wirkungen»). Ältere Patienten zeigten ein erhöhtes Hyperkaliämie-Risiko im Vergleich zu jüngeren Vergleichspersonen. Eine besonders regelmässige Kontrolle des Serum-Kaliums wird empfohlen.
Kinder und Jugendliche
Zur Anwendung von Eplerenon bei Kindern und Jugendlichen unter 18 Jahren liegen keine Daten vor. Die Anwendung bei dieser Patientengruppe wird daher nicht empfohlen.
Patienten, welche CYP3A4-Inhibitoren erhalten
Bei der gleichzeitigen Einnahme von schwachen bis mittelstarken CYP3A4-Inhibitoren beträgt die Höchstdosis von Eplerenon 25 mg/Tag.
Die gleichzeitige Einnahme von starken CYP3A4-Inhibitoren mit Eplerenon ist kontraindiziert (siehe «Kontraindikationen»).
Kontraindikationen
- Überempfindlichkeit gegenüber Eplerenon oder einem der Hilfsstoffe gemäss Zusammensetzung.
- Alle Patienten mit Serumkaliumwerten >5.0 mmol/l vor Behandlungsbeginn.
- Alle Patienten mit schwerer Niereninsuffizienz (eGFR <30 ml/min/1.73 m2).
- Alle Patienten mit schwerer Leberinsuffizienz (Child-Pugh C).
- Alle Patienten, die kaliumsparende Diuretika (z.B. Spironolacton) oder starke CYP3A4-Inhibitoren (z.B. Itraconazol, Ketoconazol, Ritonavir, Nelfinavir, Clarithromycin) erhalten (siehe «Interaktionen»).
- Hypertonie-Patienten, die kaliumhaltige Präparate/Salzersatzprodukte erhalten.
- Kombination von Eplerenon mit einer bestehenden dualen Blockade des Renin-Angiotensin-Aldosteron-Systems (ACE-Inhibitor PLUS Angiotensin-II-Rezeptor-Blocker).
Warnhinweise und Vorsichtsmassnahmen
Hyperkaliämie
Aufgrund des Wirkungsmechanismus von Eplerenon können Hyperkaliämien auftreten. Die Serum-Kalium-Werte sollten daher bei allen Patienten zu Beginn einer Behandlung sowie bei einer Dosisanpassung überwacht werden. Ausserdem wird eine periodische Kontrolle bei Patienten mit einem erhöhten Risiko zur Entwicklung einer Hyperkaliämie empfohlen (Patienten mit Niereninsuffizienz, Diabetes mellitus, ältere Patienten). Bei Kaliumwerten ≥6.0 mmol/l sollte die Behandlung mit Eplerenon abgebrochen werden (siehe «Dosierung/Anwendung»).
Das Risiko einer Hyperkaliämie kann erhöht sein, wenn Eplerenon in Kombination mit einem ACE-Inhibitor oder einem Angiotensin-Rezeptor Blocker verwendet wird. Die Kombination eines ACE-Inhibitoren und eines Angiotensin-Rezeptor Blockers darf zusammen mit Eplerenon nicht verwendet werden (siehe «Kontraindikationen» und «Interaktionen»).
Niereninsuffizienz
Bei Patienten mit eingeschränkter Nierenfunktion, einschliesslich diabetischer Mikroalbuminurie, müssen die Kaliumspiegel regelmässig überwacht werden. Nach Behandlungsbeginn soll die Dosis abhängig vom Serumkaliumspiegel angepasst werden (siehe Tabelle 1 unter «Dosierung/Anwendung»). Das Risiko einer Hyperkaliämie nimmt mit abnehmender Nierenfunktion zu. Patienten mit einer geschätzten glomerulären Filtrationsrate (eGFR) <30 ml/min/1.73 m2 dürfen nicht mit Eplerenon behandelt werden. Obwohl die Daten aus der EPHESUS-Studie zu Patienten mit einem Typ-2 Diabetes und Mikroalbuminurie begrenzt sind, wurde bei dieser kleinen Anzahl von Patienten ein erhöhtes Auftreten einer Hyperkaliämie beobachtet. Daher sollten diese Patienten mit Vorsicht behandelt werden. Eplerenon ist nicht hämodialysierbar (siehe «Dosierung/Anwendung» und «Kontraindikationen»).
Leberinsuffizienz
Bei Patienten mit leichter bis mittelstarker Leberinsuffizienz (Child-Pugh A und B) wurde kein Anstieg der Serumkaliumwerte über 5.5 mmol/l beobachtet. Eine häufige und regelmässige Kontrolle der Serumkaliumwerte wird jedoch empfohlen, insbesondere bei älteren Patienten. Die Anwendung von Eplerenon bei Patienten mit schwerer Leberinsuffizienz (Child-Pugh C) wurde nicht untersucht (siehe «Dosierung/Anwendung» und «Kontraindikationen»).
Nichtsteroidale Antirheumatika (NSAR)
Die gleichzeitige Verabreichung von anderen kaliumsparenden Substanzen mit NSAR führte zu einer Verminderung des antihypertensiven Effekts sowie bei Patienten mit Niereninsuffizienz zu einer Hyperkaliämie (siehe «Interaktionen»).
CYP3A4-Induktoren
Die Gabe von Eplerenon zusammen mit starken CYP3A4 Induktoren wird nicht empfohlen (siehe «Interaktionen»).
Andere Arzneimittel
Lithium, Ciclosporin und Tacrolimus müssen unter der Behandlung mit Eplerenon vermieden werden (siehe «Interaktionen»).
Alpha-Blocker, Amifostin, Trimethoprim, ACE-Inhibitoren und Angiotensin-II-Rezeptor-Antagonisten (siehe oben: «Hyperkaliämie»), trizyklische Antidepressiva, Neuroleptika, Baclofen, Glukokortikoide, Tetracosactid siehe «Interaktionen».
Hilfsstoffe von besonderem Interesse
Eplerenon Xiromed 25 bzw. 50 mg Filmtabletten enthalten den Hilfsstoff Laktosemonohydrat (36.92 mg bzw. 73.85 mg pro Tablette). Patienten mit der seltenen hereditären Galaktose-Intoleranz, völligem Laktasemangel oder Glucose-Galaktose- Malabsorption sollten dieses Arzneimittel nicht anwenden.
Eplerenon Xiromed 25 bzw. 50 mg Filmtabletten enthalten weniger als 1 mmol Natrium (23 mg) pro Tablette (0.43 mg bzw. 0.86 mg), d.h. sie sind nahezu «natriumfrei».
Interaktionen
Pharmakokinetische Interaktionen
In-vitro-Studien weisen darauf hin, dass Eplerenon kein Inhibitor der CYP1A2-, CYP2C19-, CYP2C9-, CYP2D6- oder CYP3A4-Isoenzyme ist. Eplerenon ist weder ein Substrat noch ein Inhibitor von P-Glycoprotein.
CYP3A4-Inhibitoren
- Starke CYP3A4-Inhibitoren: Aufgrund pharmakokinetischer Wechselwirkung ist die gleichzeitige Anwendung von Eplerenon mit starken CYP3A4-Inhibitoren wie z.B. Ketoconazol, Itraconazol, Ritonavir, Nelfinavir oder Clarithromycin kontraindiziert (siehe «Kontraindikationen»).
- Schwache bis mittelstarke CYP3A4-Inhibitoren: Die gleichzeitige Gabe mit Erythromycin, Saquinavir, Amiodaron, Diltiazem, Verapamil oder Fluconazol führte zu signifikanten pharmakokinetischen Interaktionen und einem Anstieg der AUC auf bis das 2-fache. Bei gleichzeitiger Gabe von schwachen bis mittelstarken CYP3A4-Inhibitoren mit Eplerenon sollte die Dosierung von Eplerenon daher 25 mg/Tag nicht überschreiten.
CYP3A4-Induktoren
Die gleichzeitige Gabe von Johanniskraut (einem starken CYP3A4-Induktor) mit Eplerenon führte zu einer Verringerung der AUC von Eplerenon um 30%. Bei stärkeren CYP3A4-Induktoren wie z.B. Rifampicin, dürfte eine ausgeprägtere Verringerung der AUC von Eplerenon auftreten. Aufgrund des Risikos einer verringerten Wirksamkeit von Eplerenon wird die gleichzeitige Gabe von starken CYP3A4-Induktoren (Rifampicin, Carbamazepin, Phenytoin, Phenobarbital, Johanniskraut) mit Eplerenon nicht empfohlen.
CYP3A4-Substrate
Die Ergebnisse von Pharmakokinetikstudien mit CYP3A4-Testsubstraten, z.B. Midazolam und Cisaprid, ergaben keine signifikanten pharmokokinetischen Interaktionen, wenn diese Wirkstoffe zusammen mit Eplerenon angewendet wurden.
Digoxin
Die gleichzeitige Gabe mit Eplerenon erhöht die AUC von Digoxin um 16% (90% Konfidenzintervall: 4-30%). Vorsicht ist geboten, wenn Digoxin nahe dem oberen Limit des therapeutischen Bereichs eingesetzt wird.
Warfarin
Vorsicht ist geboten, wenn Warfarin nahe dem oberen Limit des therapeutischen Bereichs eingesetzt wird.
Pharmakodynamische Interaktionen
Kaliumsparende Diuretika, kaliumhaltige Präparate/Salzersatzprodukte
Wegen des erhöhten Hyperkaliämie-Risikos darf Eplerenon nicht angewendet werden bei allen Patienten, welche andere kaliumsparende Diuretika erhalten sowie bei Hypertonie-Patienten, welche kaliumhaltige Präparate/Salzersatzprodukte erhalten (siehe «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»). Kaliumsparende Diuretika können auch die Wirkung von Antihypertonika und anderen Diuretika potenzieren.
ACE-Inhibitoren, Angiotensin-Rezeptor Blocker (ARB)
Das Risiko einer Hyperkaliämie kann erhöht sein, wenn Eplerenon in Kombination mit einem ACE-Inhibitor oder einem Angiotensin-Rezeptor Blocker verwendet wird. Eine strenge Überwachung der Serumkaliumwerte und der Nierenfunktion wird vor allem bei Patienten mit vorbestehender Einschränkung der Nierenfunktion empfohlen. Die Dreifachkombination eines ACE-Inhibitoren und eines Angiotensin-Rezeptor Blockers mit Eplerenon darf nicht angewendet werden (siehe «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»).
Lithium
Es wurden keine Arzneimittelinteraktions-Studien mit Lithium und Eplerenon durchgeführt. Bei Patienten, die Lithium zusammen mit Diuretika und ACE-Inhibitoren erhielten, wurde jedoch von einer Lithium-Toxizität berichtet. Die gemeinsame Gabe von Eplerenon und Lithium muss vermieden werden. Wenn eine Kombination notwendig erscheint, müssen die Plasmakonzentrationen von Lithium engmaschig überwacht werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Ciclosporin, Tacrolimus
Ciclosporin und Tacrolimus können zu Nierenfunktionsstörungen führen und erhöhen das Hyperkaliämie-Risiko. Die gemeinsame Gabe von Eplerenon mit Ciclosporin oder Tacrolimus muss vermieden werden. Wenn Ciclosporin und Tacrolimus während einer Behandlung mit Eplerenon gegeben werden müssen, wird eine enge Überwachung von Serumkalium und Nierenfunktion empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Nichtsteroidale Antiphlogistika (NSAR)
Speziell bei Risikopatienten (ältere und/oder dehydrierte Patienten) kann eine Behandlung mit NSAR durch direkte Beeinflussung der glomerulären Filtration zu akutem Nierenversagen führen. Vor Beginn einer Behandlung müssen Patienten, die Eplerenon und NSAR erhalten, einen ausgeglichenen Flüssigkeitshaushalt aufweisen und deren Nierenfunktion muss überprüft werden.
Trimethoprim
Die gleichzeitige Gabe von Trimethoprim und Eplerenon erhöht das Hyperkaliämie- Risiko. Besonders bei Patienten mit eingeschränkter Nierenfunktion und bei älteren Patienten muss das Serumkalium und die Nierenfunktion überwacht werden.
Alphablocker (z.B. Alfuzosin)
Bei Kombination von Alphablockern mit Eplerenon besteht die Möglichkeit, dass die antihypertensive Wirkung und/oder eine orthostatische Hypotonie verstärkt werden. Bei Begleittherapie mit Alphablockern wird eine klinische Überwachung bezüglich einer orthostatischen Hypotonie empfohlen.
Trizyklische Antidepressiva, Neuroleptika, Amifostin, Baclofen
Die Begleitmedikation mit diesen Arzneimitteln kann möglicherweise die antihypertensive Wirkung und die Gefahr einer orthostatischen Hypotonie verstärken.
Glukokortikoide, Tetracosactid
Die zusätzliche Gabe dieser Wirkstoffe zu Eplerenon kann möglicherweise die antihypertensive Wirkung verringern (Natrium- und Flüssigkeitsretention).
Schwangerschaft/Stillzeit
Schwangerschaft
Zur Anwendung von Eplerenon in der Schwangerschaft sind nur unzureichende Daten vorhanden. Eplerenon sollte während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich.
Stillzeit
Es ist unbekannt, ob Eplerenon nach oraler Einnahme in die Muttermilch übergeht. Bei eindeutiger Indikation für die Anwendung von Eplerenon soll nicht gestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Da während der Behandlung Schwindel oder Synkope auftreten können, ist beim Autofahren oder Bedienen von Maschinen Vorsicht geboten, bis die individuelle Therapieantwort bekannt ist.
Unerwünschte Wirkungen
Sowohl in der EPHESUS- als auch in der EMPHASIS-HF-Studie waren die Gesamtinzidenz unerwünschter Wirkungen sowie die Abbruchrate aufgrund von unerwünschten Wirkungen, die im Zusammenhang mit Eplerenon berichtet wurden, ähnlich wie unter Placebo. Die häufigste in der EPHESUS- und der EMPHASIS-HF-Studie gemeldete unerwünschte Wirkung war Hyperkaliämie mit einer Inzidenzrate von 3.4% bzw. 8.7% unter Eplerenon.
Die unerwünschten Wirkungen sind nach Organsystemen und ihrer absoluten Häufigkeit geordnet. Die Häufigkeiten werden wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100), selten (≥1/10'000, <1/1000), sehr selten (<1/10'000).
Infektionen und parasitäre Erkrankungen
Häufig: Infektion.
Gelegentlich: Pyelonephritis, Pharyngitis.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Eosinophilie.
Endokrine Erkrankungen
Gelegentlich: Hypothyreose.
Stoffwechsel- und Ernährungsstörungen
Häufig: Hyperkaliämie, Dehydrierung.
Gelegentlich: Hypercholesterinämie, Hypertriglyceridämie, Hyponatriämie.
Psychiatrische Erkrankungen
Gelegentlich: Schlaflosigkeit.
Erkrankungen des Nervensystems
Häufig: Schwindel, Synkope.
Gelegentlich: Kopfschmerzen, Hypästhesie.
Herzerkrankungen
Häufig: Myokardinfarkt.
Gelegentlich: Vorhofflimmern, Linksherzinsuffizienz.
Gefässerkrankungen
Häufig: Hypotonie.
Gelegentlich: Orthostatische Hypotonie, Thrombose der Beinarterien.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten.
Erkrankungen des Gastrointestinaltrakts
Häufig: Durchfall, Übelkeit, Obstipation.
Gelegentlich: Blähungen, Erbrechen.
Leber- und Gallenerkrankungen
Gelegentlich: Cholezystitis.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Juckreiz.
Gelegentlich: Hyperhidrosis.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Muskelkrämpfe, muskuloskelettale Schmerzen.
Gelegentlich: Rückenschmerzen.
Erkrankungen der Nieren und Harnwege
Häufig: Nierenfunktionsstörungen.
Allgemeine Erkrankungen
Gelegentlich: Kraftlosigkeit, Unwohlsein.
Untersuchungen
Häufig: Erhöhter Blutharnstoffwert.
Gelegentlich: Erhöhter Serumkreatininwert, verminderter EGFR-Wert (epidermal growth factor receptor), erhöhter Blutzuckerwert.
In der Ephesus-Studie kam es bei älteren Patienten (≥75 Jahre) zu einer numerisch höheren Anzahl von Schlaganfällen (Eplerenon 4.9%, Placebo 3.1%, p=0.10). In der EMPHASIS-HF Studie betrug die Anzahl von Schlaganfällen bei älteren Patienten (≥75 Jahre) n=9 (2.7%) in der Eplerenon-Gruppe und n=8 (2.4%) in der Placebo-Gruppe.
Unerwünschte Wirkungen nach Markteinführung
Post–Marketing Erfahrungen
Nach Markteinführung wurden zusätzlich folgende Nebenwirkungen beobachtet:
Erkrankungen der Haut und des Unterhautgewebes: Angioödem, Ausschlag.
Erkrankungen der Geschlechtsorgane und der Brustdrüse: Gynäkomastie.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es sind noch keine Fälle von unerwünschten Wirkungen im Zusammenhang mit einer Überdosierung von Eplerenon beim Menschen bekannt geworden. Es ist anzunehmen, dass eine Überdosierung beim Menschen zu Hypotension und Hyperkaliämie führt. Eplerenon ist nicht hämodialysierbar. Es bindet jedoch stark an Aktivkohle. Hypotension muss symptomatisch behandelt werden. Beim Auftreten einer Hyperkaliämie müssen die üblichen Therapiemassnahmen eingeleitet werden.
Eigenschaften/Wirkungen
ATC-Code
C03DA04
Wirkungsmechanismus
Siehe «Pharmakodynamik».
Pharmakodynamik
Eplerenon bindet relativ selektiv an rekombinante menschliche Mineralokortikoid- Rezeptoren verglichen mit seiner Bindungsaffinität zu rekombinanten menschlichen Glukokortikoid-, Progesteron- und Androgen-Rezeptoren. Eplerenon verhindert die Bindung von Aldosteron.
Klinische Wirksamkeit
Eplerenon wurde in der Eplerenone post-acute myocardial infarction heart failure efficacy and survival study (EPHESUS) untersucht. EPHESUS war eine doppelblinde, placebokontrollierte Multizenter-Studie an n=6632 Patienten (mittleres Follow-up 16 Monate) mit akutem Myokardinfarkt, linksventrikulärer Dysfunktion (gemessen als linksventrikuläre Ejektionsfraktion [LVEF] <40%), und klinischen Anzeichen einer Herzinsuffizienz. Die Patienten wurden 3 bis 14 Tage nach der Diagnose Myokardinfarkt randomisiert in die EPHESUS Studie aufgenommen. Die durchschnittliche Dauer bis zur Aufnahme betrug 7 Tage. Aufgrund des erhöhten kardiovaskulären Risikos assoziiert mit Diabetes, wurden Patienten mit Diabetes und einer linksventrikulären Dysfunktion in Abwesenheit von Symptomen einer Herzinsuffizienz in die Studie aufgenommen; 10% der Studienpopulation entsprachen diesem Kriterium. Zusätzlich zur Standardtherapie erhielten die Patienten entweder Eplerenon oder Placebo in einer Initialdosierung von 25 mg einmal täglich mit anschliessender Erhöhung auf die Erhaltungsdosis von 50 mg einmal täglich innerhalb von 4 Wochen bei Serumkaliumwerten <5.0 mEq/l. Während der Studie erhielten die Patienten zusätzlich eine Standardtherapie, bestehend aus Aspirin (92%), ACE-Inhibitor (90%), Betablockern (83%), Nitraten (72%), Schleifendiuretika (66%) oder HMG-CoA-Reduktase Inhibitoren (60%).
In der EPHESUS-Studie waren die co-primären Endpunkte Gesamtmortalität und der kombinierte Endpunkt aus kardiovaskulärer Mortalität oder kardiovaskulärer Hospitalisierung. Unter Eplerenon verstarben 14.4% der Patienten und unter Placebo 16.7% (alle Ursachen), während 26.7% der Patienten mit Eplerenon und 30.0% unter Placebo den kombinierten Studienendpunkt aus kardiovaskulärer Mortalität oder kardiovaskulärer Hospitalisierung erfüllten. Somit verringerte Eplerenon in der EPHESUS-Studie im Vergleich zu Placebo das Risiko der Gesamtsterblichkeit um 15% (absolute Risikoreduktion 2.3%, RR 0.85; 95% Konfidenzintervall, 0.75–0.96; p=0.008; NNT: 43), hauptsächlich durch die Reduktion der kardiovaskulären Mortalität. Das Risiko eines kardiovaskulären Todes bzw. einer kardiovaskulären Hospitalisierung wurde durch Eplerenon um 13% verringert (absolute Risikoreduktion 3.3%; RR 0.87; 95% Konfidenzintervall, 0.79–0.95; p=0.002; NNT: 31).
Die klinische Wirksamkeit einer Behandlung mit Eplerenon zeigte sich bei Patienten <75 Jahren. Der therapeutische Nutzen bei Patienten ≥75 Jahren ist unklar. Bei einem signifikant grösseren Anteil der mit Eplerenon behandelten Patienten (n=2372 Patienten, 75.3%) verbesserte sich verglichen mit Placebo (n=2242 Patienten, 71.3%) die NYHA-Klassifikation oder blieb unverändert (p<0.001).
Abbildung 1: Hazard Ratios aller Todesursachen geordnet nach Subgruppen

In Studie EMPHASIS-HF (Eplerenone in Mild Patients Hospitalization and Survival Study in Heart Failure) wurde Eplerenon zusätzlich zu einer Standardtherapie bei Patienten mit systolischer Herzinsuffizienz und milden Symptomen (NYHA-Funktionsklasse II) untersucht. Patienten der NYHA-Funktionsklassen III und IV wurden in der Studie nicht untersucht.
In die Studie aufgenommen wurden Patienten im Alter von ≥55 Jahren mit einer linksventrikulären Ejektionsfraktion (LVEF) von ≤30% oder einer LVEF ≤35% und zusätzlich einer QRS-Dauer von >130 msec. Zusätzlich mussten die Studienteilnehmer entweder innerhalb der vorangegangenen 6 Monate aufgrund einer kardiovaskulären (KV) Ursache hospitalisiert worden sein oder einen BNP-Plasmaspiegel ≥250 pg/ml oder einen Pro-BNP-Spiegel von ≥500 pg/ml (Männer) bzw. ≥750 pg/ml (Frauen) aufweisen. Die Behandlung mit Eplerenon wurde mit einer Dosis von 25 mg einmal täglich begonnen, welche nach 4 Wochen auf 50 mg einmal täglich erhöht wurde, sofern die Serumkaliumwerte bei <5.0 mmol/l und die eGFR bei ≥50 ml/min lagen. Alternativ wurde, wenn die geschätzte glomeruläre Filtrationsrate bei 30-49 ml/min/1.73 m2 lag, die Behandlung mit Eplerenon mit einer Dosis von 25 mg jeden 2. Tag begonnen, welche auf 25 mg einmal täglich erhöht werden konnte.
Die häufigsten kardiovaskulären Begleitmedikationen zusätzlich zu Eplerenon oder Plazebo bei den insgesamt n=2737 Studienteilnehmern waren Diuretika (85%), ACE-Inhibitor (78%), Angiotensin-II-Rezeptor-Antagonisten (19%), Betablocker (87%), antithrombotisch wirksame Arzneimittel (88%), Lipidsenker (63%) und Digitalisalkaloide (27%). Die mittlere LVEF betrug 26% und die mittlere QRS-Dauer lag bei 122 msec. Die meisten Patienten (83.4%) waren innerhalb der letzten 6 Monate vor der Randomisierung aufgrund kardiovaskulärer Ursachen hospitalisiert worden, ca. 50% wegen Herzinsuffizienz. Etwa 20% der Patienten hatten implantierbare Defibrillatoren oder eine kardiale Resynchronisationsbehandlung.
Der primäre Endpunkt (kardiovaskuläre Todesfälle oder Hospitalisierung wegen Herzinsuffizienz) ereignete sich bei n=249 Patienten (18.3%) der Eplerenon-Gruppe und n=356 (25.9%) der Placebo-Gruppe (RR 0.63, 95% CI, 0.54-0.74; p<0.001). Das Ergebnis war in allen untersuchten Subgruppen konsistent.
Der sekundäre Endpunkt Gesamtmortalität ereignete sich bei n=171 Patienten (12.5%) der Eplerenon-Gruppe und n=213 Patienten (15.5%) der Placebo-Gruppe (RR 0.76; 95% CI, 0.62-0.93; p=0.008). Kardiovaskuläre Todesfälle wurden bei n=147 (10.8%) Patienten der Eplerenon-Gruppe und bei n=185 (13.5%) der Placebo-Gruppe berichtet (RR 0.76; 95% CI, 0.61-0.94; p=0.01).
Während der Studie wurde bei n=158 Patienten (11.8%) der Eplerenon-Gruppe und bei n=96 Patienten (7.2%) der Placebo-Gruppe über Hyperkaliämie (Serumkaliumwerte >5.5 mmol/l) berichtet (p<0.001). Eine Hypokaliämie, definiert als Serumkaliumwerte <4.0 mmol/l, ereignete sich seltener mit Eplerenon als mit Placebo (38.9% mit Eplerenon im Vergleich zu 48.4% mit Placebo, p<0.0001).
Pharmakokinetik
Absorption
Die absolute Bioverfügbarkeit von Eplerenon beträgt 69%. Maximale Plasmakonzentrationen werden ungefähr 1.5-2 Stunden nach oraler Einnahme von Eplerenon erreicht. Die Resorption im terminalen Ileum und Colon erfolgt mit einer Verzögerung von 3-4 Stunden.
Die maximalen Plasmakonzentrationen (Cmax) wie auch die AUC-Werte sind dosisproportional in Dosierungen von 10 bis 100 mg und weniger proportional in Dosierungen über 100 mg. Die Absorption wird durch gleichzeitige Nahrungsaufnahme nicht beeinflusst.
Distribution
Die Plasmaproteinbindung von Eplerenon beträgt ca. 50%, wobei die Bindung hauptsächlich an Alpha-1-Säureglykoproteine erfolgt. Das apparente Verteilungsvolumen im Steady State wird auf 42–90 l geschätzt. Eplerenon bindet nicht bevorzugt an Erythrozyten.
Metabolismus
Die Metabolisierung von Eplerenon erfolgt hauptsächlich durch Cytochrom P450 (CYP) 3A4. Im menschlichen Plasma wurden keine aktiven Metaboliten gefunden.
Elimination
Die Eliminationshalbwertszeit beträgt 4-6 h. Die apparente Plasmaclearance beträgt ca. 10 l/h. Der Steady State wird innerhalb von 2 Tagen erreicht. Weniger als 5% der verabreichten Eplerenon-Dosis werden als unveränderte Substanz im Urin und in den Faeces gefunden. Nach oraler Einmalgabe von radioaktiv markiertem Eplerenon werden ungefähr 32% der Dosis mit den Faeces und ungefähr 67% mit dem Urin ausgeschieden.
Kinetik spezieller Patientengruppen
Alter, Geschlecht und Rasse
Die Pharmakokinetik bei Frauen und Männern unterschied sich nicht signifikant. Im Steady State wiesen ältere Probanden verglichen mit jüngeren Probanden (18 bis 45 Jahre) erhöhte Cmax- (22%) und AUC-Werte (45%) auf. Bei Menschen mit schwarzer Hautfarbe waren im Steady State die Cmax um 19% und die AUC um 26% erniedrigt (siehe «Dosierung/Anwendung»).
Leberfunktionsstörungen
Die Pharmakokinetik von 400 mg Eplerenon wurde bei Patienten mit mittelstarker Leberinsuffizienz (Child-Pugh B) untersucht und mit derjenigen von gesunden Probanden verglichen. Im Steady State waren die Cmax und AUC von Eplerenon um 3.6% resp. 42% erhöht (siehe «Dosierung/Anwendung»).
Nierenfunktionsstörungen
Die Pharmakokinetik von Eplerenon wurde bei Patienten mit unterschiedlich schwerer Niereninsuffizienz und bei Hämodialyse-Patienten untersucht. Verglichen mit gesunden Probanden, waren bei Patienten mit schwerer Niereninsuffizienz im Steady State die AUC und Cmax um 38% resp. 24% erhöht, bei Hämodialyse-Patienten um 26% resp. 3% erniedrigt. Es wurde keine Korrelation zwischen der Plasmaclearance von Eplerenon und der Kreatininclearance beobachtet. Eplerenon ist nicht hämodialysierbar (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Herzinsuffizienz
Die Pharmakokinetik von 50 mg Eplerenon wurde bei Patienten mit Herzinsuffizienz (NYHA Klassifikation II-IV) untersucht. Verglichen mit gesunden Probanden des gleichen Alters, Gewichts und Geschlechts waren die AUC und Cmax bei den Patienten mit Herzinsuffizienz um 38% resp. 30% höher. In Übereinstimmung mit den oben genannten Resultaten ergab eine pharmakokinetische Analyse basierend auf einer Subpopulation aus der EPHESUS Studie, dass die Clearance von Eplerenon bei Patienten mit Herzinsuffizienz vergleichbar mit derjenigen von gesunden älteren Probanden ist.
Präklinische Daten
Präklinische Untersuchungen zur pharmakologischen Sicherheit, Toxizität bei wiederholter Einnahme, Genotoxizität, Karzinogenität und Reproduktionstoxizität zeigten keine besonderen Risiken für den Menschen.
Studien an Ratten und Kaninchen zeigten keine teratogenen Effekte. Bei den Kaninchen-Muttertieren wurden jedoch unter der höchsten applizierten Dosis herabgesetztes Körpergewicht und erhöhte fetale Resorptionen sowie Abortrate (Verlust nach der Nidation) festgestellt. Das potentielle Risiko für den Menschen ist unbekannt.
Daten aus präklinischen Studien zeigen, dass Eplerenon und/oder seine Metaboliten in der Muttermilch von Ratten vorhanden sind.
In Studien zur chronischen Toxizität kam es bei Ratten und Hunden bei Expositionen, die mehrfach über der klinischen Dosierung lagen, zu Prostata-Atrophie. Die Veränderungen der Prostata gingen nicht mit einer negativen Funktionsveränderung einher. Die klinische Bedeutung dieser Befunde ist unklar.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 30°C lagern. In der Originalverpackung aufbewahren. Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer
68283 (Swissmedic).
Zulassungsinhaberin
Xiromed SA, 6330 Cham.
Stand der Information
September 2020.
Composizione
Principi attivi
Eplerenonum.
Sostanze ausiliarie
Compressa rivestita con film da 25 mg di eplerenone: Lactosum monohydricum (36.92 mg), cellulosum microcristallinum (E460), carmellosum natricum conexum (E468), hypromellosum (E464), natrii laurilsulfas (E487), talcum (E553b), magnesii stearas (E470b), titanii dioxidum (E171), macrogolum 4000 (E1521).
Una compressa rivestita con film da 25 mg contiene 36.92 mg di lattosio e 0.43 mg di sodio.
Compressa rivestita con film da 50 mg di eplerenone: Lactosum monohydricum (73.85 mg), cellulosum microcristallinum (E460), carmellosum natricum conexum (E468), hypromellosum (E464), natrii laurilsulfas (E487), talcum (E553b), magnesii stearas (E470b), titanii dioxidum (E171), macrogolum 4000 (E1521).
Una compressa rivestita con film da 50 mg contiene 73.85 mg di lattosio e 0.86 mg di sodio.
Forma farmaceutica e quantità di principio attivo per unità
Compressa rivestita con film.
Compresse rivestite con film da 25 mg: 1 compressa rivestita con film contiene 25 mg di eplerenone.
Compresse rivestite con film film rotonde, di colore da bianco a biancastro con «CG3» impresso su un lato e lisce sull'altro lato.
Compresse rivestite con film da 50 mg: 1 compressa rivestita con film contiene 50 mg di eplerenone.
Compresse rivestite con film rotonde, di colore da bianco a biancastro con «CG4» impresso su un lato e lisce sull'altro lato.
Indicazioni/Possibilità d'impiego
Eplerenone è indicato:
- in aggiunta ad una terapia standard, compresi i betabloccanti, per la riduzione del rischio di mortalità e morbilità cardiovascolare in pazienti stabili con disfunzione del ventricolo sinistro (LVEF ≤40%) e segni clinici di insufficienza cardiaca dopo recente infarto miocardico;
- in aggiunta ad una terapia standard ottimale, per la riduzione del rischio di mortalità e morbilità cardiovascolare in pazienti con insufficienza cardiaca (cronica) di classe NYHA II e disfunzione sistolica del ventricolo sinistro (LVEF ≤30%) (cfr. «Proprietà/effetti»).
Posologia/Impiego
Eplerenone può essere assunto indipendentemente dai pasti. Sono disponibili dosaggi da 25 mg e 50 mg per l'adeguamento individuale della dose; l'assunzione avviene una volta al giorno. La dose massima giornaliera può essere da 25 mg o da 50 mg (cfr. «Istruzioni posologiche speciali»).
Posologia abituale
Il trattamento con eplerenone non deve essere avviato in pazienti con livelli di potassio sierico superiori a 5.0 mmol/l o una eGFR <30 ml/min/1.73 m2 (cfr. «Controindicazioni»).
I livelli di potassio sierico devono deve essere determinati prima dell'inizio della terapia con eplerenone, entro la prima settimana di trattamento, entro il primo mese dall'inizio della terapia e dopo ogni adeguamento della dose. Successivamente, i livelli di potassio devono essere controllati a intervalli regolari, secondo necessità. Ciò vale in particolare per i pazienti anziani, i pazienti con diabete mellito e i pazienti con funzionalità renale ridotta.
La posologia dell'eplerenone deve essere sempre verificata in base al potassio sierico (cfr. Tabella 1).
Posologia abituale in pazienti con eGFR ≥50 ml/min/1.73 m2
I pazienti con insufficienza cardiaca di classe NYHA II e i pazienti con insufficienza cardiaca a seguito di infarto miocardico con potassio sierico ≤5 mmol/l devono ricevere una dose iniziale da 25 mg 1 volta al giorno. In base al potassio sierico (cfr. Tabella 1), la dose deve essere aumentata alla dose target di 50 mg 1 volta al giorno entro 4 settimane dall'inizio della terapia.
La dose massima per questi pazienti è pari a 50 mg/giorno.
In pazienti che hanno avuto un infarto miocardico, la terapia deve essere iniziata 3-14 giorni dopo l'evento.
Istruzioni posologiche speciali
Pazienti con disturbi della funzionalità epatica
Non è necessario alcun adeguamento della dose iniziale nei pazienti con insufficienza epatica da lieve a moderata. Poiché tuttavia nei pazienti con insufficienza epatica da lieve a moderata si ha un aumento dell'esposizione sistemica al principio attivo eplerenone, si raccomanda un controllo frequente e regolare dei livelli di potassio sierico, soprattutto nei pazienti anziani (cfr. «Avvertenze e misure precauzionali»).
L'uso dell'eplerenone è controindicato nei pazienti con insufficienza epatica grave (Child-Pugh C) (cfr. «Controindicazioni»).
Tabella 1: adeguamento della dose dopo l'inizio del trattamento
Livelli di potassio sierico (mmol/l) | Modifica della posologia | Adeguamento della dose |
<5.0 | Aumento | Dalla sospensione del trattamento a 25 mg ogni 2 giorni. Da 25 mg ogni 2 giorni a 25 mg 1 volta al giorno. Da 25 mg una volta al giorno a 50 mg 1 volta al giorno, tranne nei: Pazienti con eGFR 30-49 ml/min/1.73 m2 Pazienti che assumono un inibitore del CYP3A4 da debole a moderato. |
5.0-5.4 | Nessuna | Nessuna modifica. |
5.5-5.9 | Riduzione | Da 50 mg 1 volta al giorno a 25 mg 1 volta al giorno. Da 25 mg 1 volta al giorno a 25 mg ogni 2 giorni. Da 25 mg ogni 2 giorni alla sospensione del trattamento. |
≥6.0 | Sospensione del trattamento | Ricominciare con 25 mg ogni 2 giorni se il potassio <5.0 mmol/l. |
Pazienti con disturbi della funzionalità renale
Pazienti con insufficienza renale moderata (eGFR tra 30 e 49 ml/min/1.73 m2)
I pazienti con insufficienza cardiaca di classe NYHA II e un potassio sierico ≤5 mmol/l devono ricevere una dose iniziale da 25 mg ogni 2 giorni. Tale dose deve essere aumentata alla dose target da 25 mg/giorno entro 4 settimane dall'inizio della terapia, in base al potassio sierico (cfr. Tabella 1). La dose massima è di 25 mg/giorno.
Non sono disponibili esperienze per quanto riguarda i pazienti con insufficienza cardiaca a seguito di infarto miocardico e clearance della creatinina <50 ml/min. Eplerenone deve essere usato con cautela in questi pazienti.
Pazienti con insufficienza renale grave (eGFR <30 ml/min/1.73 m2)
L'uso di eplerenone è controindicato in questi pazienti.
Eplerenone non è dializzabile.
Pazienti anziani
Nello studio EMPHASIS-HF sono stati trattati con eplerenone n=330 pazienti ≥75 anni. La dose del trattamento dipendeva dalla funzionalità renale (cfr. «Proprietà/effetti»). I pazienti anziani presentavano un rischio di iperkaliemia maggiore rispetto ai soggetti di controllo più giovani. Si raccomanda un controllo particolarmente regolare del potassio sierico.
Bambini e adolescenti
Non sono disponibili dati sull'uso di eplerenone nei bambini e negli adolescenti di età inferiore ai 18 anni. Pertanto, l'uso non è consigliato in questo gruppo di pazienti.
Pazienti che ricevono inibitori del CYP3A
La dose massima di eplerenone in caso di assunzione concomitante di inibitori da deboli a moderati del CYP3A4 è pari a 25 mg/giorno.
L'assunzione concomitante di forti inibitori del CYP3A4 ed eplerenone è controindicata (cfr. «Controindicazioni»).
Controindicazioni
- Ipersensibilità all'eplerenone o a una delle sostanze ausiliarie secondo la composizione.
- Tutti i pazienti con livelli di potassio sierico >5.0 mmol/l prima dell'inizio del trattamento.
- Tutti i pazienti con insufficienza renale grave (eGFR <30 ml/min/1.73 m2).
- Tutti i pazienti con insufficienza epatica grave (Child-Pugh C).
- Tutti i pazienti che ricevono diuretici risparmiatori di potassio (ad es. spironolattone) o forti inibitori del CYP3A4 (ad es. itraconazolo, ketoconazolo, ritonavir, nelfinavir, claritromicina) (cfr. «Interazioni»).
- Pazienti ipertesi che ricevono preparati/sostituti del sale contenenti potassio.
- Combinazione di eplerenone con un duplice blocco del sistema renina-angiotensina-aldosterone (un ACE-inibitore PIÙ un bloccante del recettore dell'angiotensina II) in atto.
Avvertenze e misure precauzionali
Iperkaliemia
In virtù del meccanismo d'azione dell'eplerenone possono insorgere iperkaliemie. Pertanto, i livelli di potassio sierico devono essere monitorati in tutti i pazienti all'inizio del trattamento nonché nel caso di un adeguamento della dose. È inoltre raccomandato un controllo periodico nei pazienti maggiormente a rischio di sviluppare iperkaliemia (pazienti con insufficienza renale, diabete mellito, pazienti anziani). Se i livelli di potassio sono ≥6.0 mmol/l, il trattamento con eplerenone deve essere interrotto definitivamente (cfr. «Posologia/impiego»).
Il rischio di iperkaliemia può aumentare quando l'eplerenone è somministrato in combinazione con un ACE-inibitore o un bloccante del recettore dell'angiotensina. La combinazione di un ACE-inibitore e un bloccante del recettore dell'angiotensina non deve essere utilizzata insieme all'eplerenone (cfr. «Controindicazioni» e «Interazioni»).
Insufficienza renale
I livelli di potassio devono essere regolarmente monitorati in pazienti con funzionalità renale ridotta, inclusa la microalbuminuria diabetica. Dopo l'inizio del trattamento, la dose deve essere adeguata in base ai livelli di potassio sierico (cfr. Tabella 1 alla rubrica «Posologia/impiego»). Il rischio di iperkaliemia aumenta al diminuire della funzionalità renale. I pazienti con velocità di filtrazione glomerulare stimata (eGFR) <30 ml/min/1.73 m2 non devono essere trattati con eplerenone. Sebbene i dati dello studio EPHESUS relativi a pazienti con diabete di tipo 2 e microalbuminuria siano limitati, in questo piccolo numero di pazienti è stata osservata un'aumentata incidenza di iperkaliemia. Pertanto, tali pazienti devono essere trattati con cautela. Eplerenone non è emodializzabile (cfr. «Posologia/impiego» e «Controindicazioni»).
Insufficienza epatica
Nei pazienti con insufficienza epatica da lieve a moderata (Child-Pugh A e B) non sono stati osservati aumenti dei livelli di potassio sierico oltre 5.5 mmol/l. Si raccomanda tuttavia un controllo frequente e regolare dei livelli di potassio sierico, soprattutto nei pazienti anziani. L'uso di eplerenone non è stato esaminato in pazienti con insufficienza epatica grave (Child-Pugh C) (cfr. «Posologia/impiego» e «Controindicazioni»).
Antinfiammatori non steroidei (FANS)
La somministrazione concomitante di altre sostanze risparmiatrici di potassio e FANS ha portato ad una riduzione dell'effetto antipertensivo e, nei pazienti con insufficienza renale, a iperkaliemia (cfr. «Interazioni»).
Induttori del CYP3A4
La somministrazione di eplerenone insieme a forti induttori del CYP3A4 non è consigliata (cfr. «Interazioni»).
Altri medicamenti
Litio, ciclosporina e tacrolimus devono essere evitati durante il trattamento con eplerenone (cfr. «Interazioni»).
Per alfa-bloccanti, amifostina, trimetoprim, ACE-inibitori e antagonisti del recettore dell'angiotensina II (cfr. sopra: «Iperkaliemia»), antidepressivi triciclici, neurolettici, baclofene, glucocorticoidi, tetracosactide, cfr. «Interazioni».
Sostanze ausiliarie di particolare interesse
Eplerenone Xiromed 25 e 50 mg compresse rivestite con film contiene la sostanza ausiliaria lattosio monoidrato (rispettivamente 36.92 mg e 73.85 mg per compressa). I pazienti affetti da rari problemi ereditari di intolleranza al fruttosio, intolleranza al galattosio, galattosemia, o da malassorbimento di glucosio-galattosio, non devono assumere questo medicamento.
Eplerenone Xiromed 25 e 50 mg compresse rivestite con film contiene meno di 1 mmol (23 mg) di sodio per compressa (rispettivamente 0.43 mg e 0.86 mg), cioè essenzialmente «senza sodio».
Interazioni
Interazioni farmacocinetiche
Gli studi in vitro indicano che eplerenone non è un inibitore degli isoenzimi CYP1A2, CYP2C19, CYP2C9, CYP2D6 o CYP3A4. Eplerenone non è né un substrato né un inibitore della P-glicoproteina.
Inibitori del CYP3A4
- Forti inibitori del CYP3A4: l'uso concomitante di eplerenone con forti inibitori del CYP3A4 come ad es. ketoconazolo, itraconazolo, ritonavir, nelfinavir o claritromicina è controindicato per l'esistenza di un'interazione farmacocinetica (cfr. «Controindicazioni»).
- Inibitori del CYP3A4 da deboli a moderati: la somministrazione concomitante con eritromicina, saquinavir, amiodarone, diltiazem, verapamil o fluconazolo ha portato a interazioni farmacocinetiche significative e ad un aumento fino a 2 volte dell'AUC. Pertanto, in caso di somministrazione concomitante di inibitori del CYP3A4 da deboli a moderati ed eplerenone, il dosaggio di eplerenone non deve superare i 25 mg/giorno.
Induttori del CYP3A4
La somministrazione concomitante di erba di San Giovanni (un potente induttore del CYP3A4) ed eplerenone ha portato ad una riduzione del 30% dell'AUC dell'eplerenone. Con induttori del CYP3A4 più potenti, come ad es. la rifampicina, la riduzione dell'AUC dell'eplerenone potrebbe essere più marcata. Dato il rischio di una riduzione dell'efficacia dell'eplerenone, la somministrazione concomitante di forti inibitori del CYP3A4 (rifampicina, carbamazepina, fenitoina, fenobarbital, erba di San Giovanni) ed eplerenone non è consigliata.
Substrati del CYP3A4
I risultati degli studi di farmacocinetica con substrati sperimentali del CYP3A4, come ad es. midazolam e cisapride, non hanno rivelato interazioni farmacocinetiche significative quando tali principi attivi sono stati utilizzati insieme ad eplerenone.
Digossina
La somministrazione concomitante con eplerenone aumenta la AUC della digossina del 16% (intervallo di confidenza al 90%: 4-30%). Si raccomanda cautela quando la digossina è impiegata a dosi prossime al limite superiore dell'intervallo terapeutico.
Warfarin
Si raccomanda cautela quando il warfarin è impiegato a dosi prossime al limite superiore dell'intervallo terapeutico.
Interazioni farmacodinamiche
Diuretici risparmiatori di potassio, preparati/sostituti del sale contenenti potassio
A causa dell'aumentato rischio di iperkaliemia, eplerenone non deve essere usato in tutti quei pazienti che utilizzano diuretici risparmiatori di potassio e nei pazienti ipertesi che utilizzano preparati/sostituti del sale contenenti potassio (cfr. «Controindicazioni» e «Avvertenze e misure precauzionali»). I diuretici risparmiatori di potassio possono anche potenziare l'effetto di altri antipertensivi e di altri diuretici.
ACE-inibitori, bloccanti del recettore dell'angiotensina (ARB)
Il rischio di iperkaliemia può aumentare quando l'eplerenone è somministrato in combinazione con un ACE-inibitore o un bloccante del recettore dell'angiotensina. Si raccomanda un rigoroso monitoraggio dei livelli di potassio sierico e della funzionalità renale, soprattutto in pazienti con preesistente riduzione della funzionalità renale. La tripla combinazione di un ACE-inibitore, un bloccante del recettore dell'angiotensina ed eplerenone non deve essere utilizzata (cfr. «Controindicazioni» e «Avvertenze e misure precauzionali»).
Litio
Non sono stati effettuati studi di interazione farmacologica con litio ed eplerenone. Tuttavia, una tossicità da litio è stata riportata in pazienti trattati con litio insieme a diuretici e ACE-inibitori. La somministrazione concomitante di eplerenone e litio deve essere evitata. Se questa combinazione risulta necessaria, è necessario un rigoroso monitoraggio delle concentrazioni plasmatiche del litio (cfr. «Avvertenze e misure precauzionali»).
Ciclosporina, tacrolimus
Ciclosporina e tacrolimus possono portare a disturbi della funzionalità renale e aumentano il rischio di iperkaliemia. La somministrazione concomitante di eplerenone e ciclosporina o tacrolimus deve essere evitata. Nel caso in cui ciclosporina e tacrolimus debbano essere somministrati durante un trattamento con eplerenone, si raccomanda un attento monitoraggio del potassio sierico e della funzionalità renale (cfr. «Avvertenze e misure precauzionali»).
Antinfiammatori non steroidei (FANS)
Il trattamento con FANS può portare ad insufficienza renale acuta agendo direttamente sulla filtrazione glomerulare, soprattutto nei pazienti a rischio (pazienti anziani e/o disidratati). I pazienti trattati con eplerenone e FANS devono presentare un normale equilibrio idrico e la loro funzionalità renale deve essere verificata prima di iniziare il trattamento.
Trimetoprim
La somministrazione concomitante di trimetoprim ed eplerenone aumenta il rischio di iperkaliemia. Devono essere monitorati il potassio sierico e la funzionalità renale, soprattutto in pazienti con funzionalità renale ridotta e nei pazienti anziani.
Alfa-bloccanti (ad es. alfuzosina)
La combinazione di alfa-bloccanti ed eplerenone può potenziare l'effetto antipertensivo e/o un'ipotensione ortostatica. In caso di terapia concomitante con alfa-bloccanti, si raccomanda il monitoraggio clinico dell'ipotensione ortostatica.
Antidepressivi triciclici, neurolettici, amifostina, baclofene
La terapia concomitante con questi medicamenti può potenzialmente potenziare l'effetto antipertensivo e il rischio di ipotensione ortostatica.
Glucocorticoidi, tetracosactide
La somministrazione di questi principi attivi in aggiunta ad eplerenone può potenzialmente ridurre l'effetto antipertensivo (ritenzione di sodio e di liquidi).
Gravidanza/Allattamento
Gravidanza
Non sono disponibili dati sufficienti sull'uso di eplerenone in gravidanza. Eplerenone non deve essere utilizzato durante la gravidanza, a meno che ciò non sia inequivocabilmente necessario.
Allattamento
Non è noto se eplerenone sia escreto nel latte materno dopo l'assunzione orale. Se vi è una chiara indicazione all'uso di eplerenone, non si deve allattare.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Poiché durante il trattamento possono comparire vertigini o sincope, si raccomanda cautela durante la guida di veicoli o l'utilizzo di macchine, finché non si conosce la risposta individuale alla terapia.
Effetti indesiderati
Sia nello studio EPHESUS sia nello studio EMPHASIS-HF, l'incidenza globale degli effetti indesiderati e il tasso di interruzioni per effetti indesiderati riportati in associazione ad eplerenone sono risultati simili a quelli osservati con il placebo. L'effetto indesiderato più comune segnalato negli studi EPHESUS ed EMPHASIS-HF è stata l'iperkaliemia, con un tasso di incidenza rispettivamente del 3.4% e 8.7% per eplerenone.
Gli effetti indesiderati sono elencati per sistema organico e frequenza assoluta. Le frequenze vengono definite come segue: molto comune (≥1/10), comune (≥1/100, <1/10), non comune (≥1/1'000, <1/100), raro (≥1/10'000, <1/1'000), molto raro (<1/10'000).
Infezioni ed infestazioni
Comune: infezione.
Non comune: pielonefrite, faringite.
Patologie del sistema emolinfopoietico
Non comune: eosinofilia.
Patologie endocrine
Non comune: ipotiroidismo.
Disturbi del metabolismo e della nutrizione
Comune: iperkaliemia, disidratazione.
Non comune: ipercolesterolemia, ipertrigliceridemia, iponatriemia.
Disturbi psichiatrici
Non comune: insonnia.
Patologie del sistema nervoso
Comune: vertigini, sincope.
Non comune: cefalea, ipoestesia.
Patologie cardiache
Comune: infarto miocardico.
Non comune: fibrillazione atriale, insufficienza ventricolare sinistra.
Patologie vascolari
Comune: ipotensione.
Non comune: ipotensione ortostatica, trombosi delle arterie delle gambe.
Patologie respiratorie, toraciche e mediastiniche
Comune: tosse.
Patologie gastrointestinali
Comune: diarrea, nausea, stipsi.
Non comune: meteorismo, vomito.
Patologie epatobiliari
Non comune: colecistite.
Patologie della cute e del tessuto sottocutaneo
Comune: prurito.
Non comune: iperidrosi.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Comune: crampi muscolari, dolore muscoloscheletrico.
Non comune: dolore dorsale.
Patologie renali e urinarie
Comune: disturbi della funzionalità renale.
Patologie generali
Non comune: astenia, malessere.
Esami diagnostici
Comune: urea ematica aumentata.
Non comune: creatinina sierica aumentata, riduzione del recettore del fattore di crescita epidermico (Epidermal Growth Factor Receptor, EGFR), glucosio ematico aumentato.
Nello studio EPHESUS, è stato osservato un numero più alto di ictus nei pazienti anziani (≥75 anni) (eplerenone 4.9%, placebo 3.1%, p=0.10). Nello studio EMPHASIS-HF, il numero di ictus nei pazienti anziani (≥75 anni) è stato pari a n=9 (2.7%) nel gruppo eplerenone e n=8 (2.4%) nel gruppo placebo.
Effetti indesiderati dopo l'introduzione sul mercato
Esperienze post-marketing
Dopo l'introduzione sul mercato sono stati inoltre osservati i seguenti effetti collaterali:
Patologie della cute e del tessuto sottocutaneo: angioedema, eruzione cutanea.
Patologie dell'apparato riproduttivo e della mammella: ginecomastia.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi effetto indesiderato sospetto, nuovo o serio, attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Non sono stati ancora segnalati casi di effetti indesiderati associati ad un sovradosaggio di eplerenone nell'uomo. Si presume che un sovradosaggio nell'uomo porti ad ipotensione e iperkaliemia. Eplerenone non è emodializzabile, ma si lega fortemente al carbone attivo. L'ipotensione richiede trattamento sintomatico. Se si verifica un'iperkaliemia devono essere introdotte le consuete misure terapeutiche.
Proprietà/Effetti
Codice ATC
C03DA04
Meccanismo d'azione
Cfr. «Farmacodinamica».
Farmacodinamica
L'eplerenone si lega in maniera relativamente selettiva ai recettori umani ricombinanti dei mineralcorticoidi rispetto alla sua affinità di legame per i recettori umani ricombinanti dei glucocorticoidi, del progesterone e degli androgeni. L'eplerenone impedisce il legame dell'aldosterone.
Efficacia clinica
L'eplerenone è stato valutato nello studio Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study (EPHESUS). EPHESUS è stato uno studio multicentrico, in doppio cieco, controllato verso placebo condotto in n=6632 pazienti (follow-up medio 16 mesi) con infarto miocardico acuto, disfunzione del ventricolo sinistro (misurata come frazione di eiezione ventricolare sinistra [LVEF] <40%) e segni clinici di insufficienza cardiaca. I pazienti sono stati randomizzati nello studio EPHESUS 3-14 giorni dopo la diagnosi di infarto miocardico. Il tempo medio all'arruolamento era di 7 giorni. A causa dell'aumento del rischio cardiovascolare associato al diabete, sono stati arruolati nello studio i pazienti con diabete e disfunzione del ventricolo sinistro in assenza di sintomi di insufficienza cardiaca; il 10% della popolazione dello studio rispondeva a questo criterio. Oltre alla terapia standard, i pazienti ricevevano eplerenone o placebo ad un dosaggio iniziale da 25 mg una volta al giorno, successivamente aumentato alla dose di mantenimento da 50 mg una volta al giorno entro 4 settimane in presenza di livelli di potassio sierico <5.0 mEq/l. Durante lo studio, i pazienti ricevano anche una terapia standard composta da aspirina (92%), ACE-inibitori (90%), beta-bloccanti (83%), nitrati (72%), diuretici dell'ansa (66%) o inibitori della HMG-CoA reduttasi (60%).
Nello studio EPHESUS, gli endpoint co-primari erano la mortalità globale e l'endpoint combinato di mortalità cardiovascolare od ospedalizzazione per cause cardiovascolari. Il 14.4% dei pazienti trattati con eplerenone e il 16.7% di quelli trattati con placebo sono deceduti (per tutte le cause), mentre il 26.7% dei pazienti trattati con eplerenone e il 30.0% di quelli trattati con placebo hanno raggiunto l'endpoint combinato di mortalità cardiovascolare od ospedalizzazione per cause cardiovascolari dello studio. Pertanto, nello studio EPHESUS l'eplerenone ha ridotto del 15% il rischio di mortalità globale rispetto al placebo (riduzione assoluta del rischio 2.3%, RR 0.85; intervallo di confidenza al 95%, 0.75–0.96; p=0.008; NNT: 43), principalmente attraverso la riduzione della mortalità cardiovascolare. Con eplerenone, il rischio di morte cardiovascolare o di ospedalizzazione per cause cardiovascolari si è ridotto del 13% (riduzione assoluta del rischio 3.3%; RR 0.87; intervallo di confidenza al 95%, 0.79–0.95; p=0.002; NNT: 31).
L'efficacia clinica del trattamento è stata dimostrata in pazienti <75 anni. Il beneficio terapeutico nei pazienti ≥75 anni non è chiaro. In una percentuale significativamente maggiore di pazienti trattati con eplerenone (n=2372 pazienti, 75.3%) la classificazione NYHA è migliorata rispetto al placebo (n=2'242 pazienti, 71.3%) o è rimasta invariata (p<0.001).
Figura 1: hazard ratio di tutte le cause di morte, ordinate per sottogruppi

Lo studio EMPHASIS-HF (Eplerenone in Mild Patients Hospitalization and Survival Study in Heart Failure) ha valutato eplerenone in aggiunta ad una terapia standard in pazienti con insufficienza cardiaca sistolica e sintomi lievi (classe funzionale NYHA II). Lo studio non ha valutato pazienti con classi funzionali NYHA III e IV.
Sono stati arruolati nello studio pazienti di età ≥55 anni con frazione di eiezione ventricolare sinistra (LVEF) ≤30% o una LVEF ≤35% ed una durata del QRS >130 msec. Inoltre, i partecipanti allo studio dovevano presentare un'ospedalizzazione per cause cardiovascolari (CV) nei precedenti 6 mesi o avere un livello plasmatico di BNP ≥250 pg/ml o un livello di Pro-BNP ≥500 pg/ml (uomini) e ≥750 pg/ml (donne). Il trattamento con eplerenone veniva iniziato ad una dose da 25 mg una volta al giorno, che veniva aumentata a 50 mg una volta al giorno dopo 4 settimane se i livelli di potassio sierico erano <5.0 mmol/l e la eGFR era ≥50 ml/min. In alternativa, se la velocità di filtrazione glomerulare stimata era 30-49 ml/min/1.73 m2, il trattamento con eplerenone veniva avviato ad una dose da 25 mg ogni 2 giorni, che poteva essere aumentata a 25 mg una volta al giorno.
Le terapie cardiovascolari concomitanti più comunemente somministrate in aggiunta all'eplerenone o al placebo nel totale dei n=2737 partecipanti allo studio erano diuretici (85%), ACE-inibitori (78%), antagonisti del recettore dell'angiotensina II (19%), betabloccanti (87%), medicamenti ad azione antitrombotica (88%), ipolipemizzanti (63%) e alcaloidi della digitale (27%). La LVEF media era pari al 26% e la durata media del QRS era di 122 msec. La maggior parte dei pazienti (83.4%) presentava un'ospedalizzazione per cause cardiovascolari negli ultimi 6 mesi prima della randomizzazione, ca. il 50% per insufficienza cardiaca. Circa il 20% dei pazienti presentava defibrillatori impiantabili o era stato sottoposto a trattamento di risincronizzazione cardiaca.
L'endpoint primario (casi di morte cardiovascolare o di ospedalizzazione per insufficienza cardiaca) si è verificato in n=249 pazienti (18.3%) del gruppo eplerenone e n=356 (25.9%) del gruppo placebo (RR 0.63, IC 95%, 0.54-0.74; p<0.001). Il risultato è stato coerente in tutti i sottogruppi valutati.
L'endpoint secondario della mortalità globale si è verificato in n=171 pazienti (12.5%) del gruppo eplerenone e n=213 pazienti (15.5%) del gruppo placebo (RR 0.76; IC 95%, 0.62-0.93; p=0.008). Casi di morte cardiovascolare sono stati riportati in n=147 (10.8%) pazienti del gruppo eplerenone e n=185 (13.5%) pazienti del gruppo placebo (RR 0.76; IC 95%, 0.61-0.94; p=0.01).
Durante lo studio, l'iperkaliemia (livelli di potassio sierico >5.5 mmol/l) è stata riportata in n=158 pazienti (11.8%) del gruppo eplerenone e in n=96 pazienti (7.2%) del gruppo placebo (p<0.001). L'ipokaliemia, definita come livelli di potassio sierico <4.0 mmol/l, si è verificata più raramente con eplerenone rispetto al placebo (38.9% con eplerenone, contro il 48.4% del placebo, p<0.0001).
Farmacocinetica
Assorbimento
La biodisponibilità assoluta dell'eplerenone è del 69%. Le concentrazioni plasmatiche massime vengono raggiunte circa 1.5-2 h dopo l'assunzione orale di eplerenone. L'assorbimento nel tratto terminale dell'ileo e del colon avviene con un ritardo di 3-4 h.
Le concentrazioni plasmatiche massime (Cmax) e i valori dell'AUC sono proporzionali alla dose a dosaggi compresi tra 10 e 100 mg e meno proporzionali a dosaggi superiori a 100 mg. L'assorbimento non è influenzato dall'assunzione concomitante di cibo.
Distribuzione
Il legame alle proteine plasmatiche dell'eplerenone è di ca. il 50% ed avviene principalmente a livello delle glicoproteine acide alfa-1. Il volume di distribuzione apparente allo stato stazionario è stimato a 42-90 l. L'eplerenone non si lega in modo preferenziale agli eritrociti.
Metabolismo
L'eplerenone è metabolizzato principalmente dal citocromo P450 (CYP) 3A4. Non sono stati individuati metaboliti attivi nel plasma umano.
Eliminazione
L'emivita di eliminazione è di 4-6 h. La clearance plasmatica apparente è di ca. 10 l/h. Lo stato stazionario viene raggiunto entro 2 giorni. Meno del 5% della dose di eplerenone somministrata è recuperata nelle urine e nelle feci come sostanza immodificata. Dopo somministrazione singola orale di eplerenone radiomarcato, circa il 32% della dose è eliminato con le feci e circa il 67% con le urine.
Cinetica di gruppi di pazienti speciali
Età, sesso e razza
La farmacocinetica non si è differenziata in misura significativa tra uomini e donne. Allo stato stazionario, i volontari anziani presentavano valori di Cmax (22%) e dell'AUC (45%) aumentati rispetto ai volontari più giovani (18-45 anni). Nelle persone di colore, la Cmax e l'AUC allo stato stazionario erano ridotte del 19% e del 26% (cfr. «Posologia/impiego»).
Disturbi della funzionalità epatica
La farmacocinetica di 400 mg di eplerenone è stata valutata in pazienti con insufficienza epatica moderata (Child-Pugh B) e confrontata con quella dei volontari sani. Allo stato stazionario, la Cmax e l'AUC dell'eplerenone erano aumentate rispettivamente del 3.6% e del 42% (cfr. «Posologia/impiego»).
Disfunzioni renali
La farmacocinetica dell'eplerenone è stata valutata in pazienti con insufficienza renale di gravità variabile e in pazienti emodializzati. Rispetto ai volontari sani, la AUC e la Cmax allo stato stazionario sono risultate aumentate rispettivamente del 38% e del 24% nei pazienti con insufficienza renale grave e ridotte rispettivamente del 26% e del 3% nei pazienti emodializzati. Non è stata osservata alcuna correlazione tra la clearance plasmatica dell'eplerenone e la clearance della creatinina. L'eplerenone non è emodializzabile (cfr. «Avvertenze e misure precauzionali»).
Insufficienza cardiaca
La farmacocinetica di 50 mg di eplerenone è stata valutata in pazienti con insufficienza cardiaca (classificazione NYHA II-IV). Rispetto ai volontari sani di età, peso e sesso equivalente, nei pazienti con insufficienza cardiaca l'AUC e la Cmax erano più alte rispettivamente del 38% e del 30%. In linea con i suddetti risultati, un'analisi farmacocinetica basata su una sottopopolazione dello studio EPHESUS ha rivelato che la clearance dell'eplerenone nei pazienti con insufficienza cardiaca è paragonabile a quella dei volontari anziani sani.
Dati preclinici
Gli studi preclinici su farmacologia di sicurezza, tossicità per somministrazione ripetuta, genotossicità, cancerogenicità e tossicità per la riproduzione non hanno evidenziato alcun rischio particolare per l'essere umano.
Gli studi nel ratto e nel coniglio non hanno evidenziato effetti teratogeni. Tuttavia, nelle madri coniglio trattate alla dose massima somministrata sono stati osservati una riduzione del peso corporeo e un aumento dei riassorbimenti fetali nonché del tasso di aborti (perdita post-impianto). I rischi potenziali per l'uomo non sono noti.
I dati degli studi preclinici mostrano che eplerenone e/o i suoi metaboliti sono presenti nel latte materno del ratto.
In studi sulla tossicità cronica è stata osservata atrofia della prostata in ratti e cani ad esposizioni più volte superiori alla posologia clinica. Le alterazioni a livello della prostata non erano accompagnate da alterazioni funzionali negative. La rilevanza clinica di queste osservazioni non è chiara.
Altre indicazioni
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Precauzioni particolari per la conservazione
Non conservare a temperature superiori a 30°C. Conservare nella confezione originale. Tenere fuori dalla portata dei bambini.
Numero dell'omologazione
68283 (Swissmedic).
Titolare dell’omologazione
Xiromed SA, 6330 Cham.
Stato dell'informazione
Settembre 2020.
Composition
Principes actifs
Eplerenonum.
Excipients
Comprimé pelliculé à 25 mg d'éplérénone: Lactosum monohydricum (36.92 mg), cellulosum microcristallinum (E460), carmellosum natricum conexum (E468), hypromellosum (E464), natrii laurilsulfas (E487), talcum (E553b), magnesii stearas (E470b), titanii dioxidum (E171), macrogolum 4000 (E1521).
Un comprimé pelliculé à 25 mg contient 36.92 mg de lactose et 0.43 mg de sodium.
Comprimé pelliculé à 50 mg d'éplérénone: Lactosum monohydricum (73.85 mg), cellulosum microcristallinum (E460), carmellosum natricum conexum (E468), hypromellosum (E464), natrii laurilsulfas (E487), talcum (E553b), magnesii stearas (E470b), titanii dioxidum (E171), macrogolum 4000 (E1521).
Un comprimé pelliculé à 50 mg contient 73.85 mg de lactose et 0.86 mg de sodium.
Forme pharmaceutique et quantité de principe actif par unité
Comprimé pelliculé.
Comprimés pelliculés à 25 mg: 1 comprimé pelliculé contient 25 mg d'éplérénone.
Comprimés pelliculés ronds, de couleur blanche à blanc cassé avec l'inscription «CG3» gravée sur une face et sans inscription sur l'autre face.
Comprimés pelliculés à 50 mg: 1 comprimé pelliculé contient 50 mg d'éplérénone.
Comprimés pelliculés ronds, de couleur blanche à blanc cassé avec l'inscription «CG4» gravée sur une face et sans inscription sur l'autre face.
Indications/Possibilités d’emploi
L'éplérénone est indiquée:
- en complément à un traitement standard incluant des bêtabloquants, pour réduire le risque de mortalité et de morbidité cardiovasculaires chez le patient stable présentant une dysfonction ventriculaire gauche (FEVG ≤40%) et des signes cliniques d'insuffisance cardiaque après un infarctus du myocarde récent;
- en complément à un traitement standard optimal pour réduire le risque de mortalité et de morbidité d'origine cardiovasculaire chez le patient atteint d'insuffisance cardiaque (chronique) de classe II selon la NYHA et de dysfonction ventriculaire gauche systolique (FEVG ≤30%) (voir «Propriétés/Effets»).
Posologie/Mode d’emploi
L'éplérénone peut être prise indépendamment des repas. Les doses de 25 mg et 50 mg sont disponibles pour adapter la posologie individuelle. Il convient de prendre une dose par jour. La dose maximale journalière est de 25 mg ou 50 mg (voir «Instructions posologiques particulières»).
Posologie usuelle
Un traitement par éplérénone ne doit pas être instauré chez les patients présentant une kaliémie supérieure à 5.0 mmol/l ou un TFGe (taux de filtration glomérulaire estimé) <30 ml/min/1.73 m2 (voir «Contre-indications»).
La kaliémie doit être mesurée avant l'initiation du traitement par éplérénone, pendant la première semaine de traitement, le premier mois après le début du traitement ainsi qu'après chaque ajustement de la posologie. Par la suite, la kaliémie sera contrôlée périodiquement selon les besoins. Cela s'applique surtout aux patients âgés, aux patients diabétiques et aux patients présentant une altération de la fonction rénale.
La posologie de l'éplérénone doit être toujours vérifiée en fonction du potassium sérique (voir Tableau 1).
Posologie usuelle chez les patients présentant un TFGe ≥50 ml/min/1.73 m2
Les patients atteints d'une insuffisance cardiaque de classe II selon la NYHA ainsi que les patients atteints d'une insuffisance cardiaque après un infarctus du myocarde qui présentent un potassium sérique ≤5 mmol/l doivent recevoir une dose initiale de 25 mg, administrée 1x par jour. En fonction du potassium sérique (voir Tableau 1), la dose doit être augmentée à la dose cible de 50 mg, administrée 1x par jour, dans les 4 semaines suivant le début du traitement.
La dose maximale chez ces patients est de 50 mg/jour.
Chez les patients qui ont présenté un infarctus du myocarde, le traitement doit être instauré 3 à 14 jours après l'événement.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Aucune adaptation de la posologie initiale n'est nécessaire chez les patients présentant une insuffisance hépatique légère à modérée. Cependant, en raison d'une exposition systémique plus importante à l'éplérénone chez les patients ayant une insuffisance hépatique légère à modérée, un contrôle fréquent et régulier de la kaliémie est recommandé, en particulier chez le patient âgé (voir «Mises en garde et précautions»).
L'utilisation de l'éplérénone est contre-indiquée chez les patients présentant une insuffisance hépatique sévère (Child-Pugh C) (voir «Contre-indications»).
Tableau 1: Adaptations posologiques après le début du traitement
Kaliémie (mmol/l) | Modification de la posologie | Adaptation posologique |
<5.0 | Augmentation | Passer de la pause thérapeutique à 25 mg tous les 2 jours. Passer de 25 mg tous les 2 jours à 25 mg 1x par jour. Passer de 25 mg une fois par jour à 50 mg 1x par jour sauf chez: les patients présentant un TFGe compris entre 30 et 49 ml/min/1.73 m2 les patients prenant un inhibiteur faible à modéré du CYP3A4. |
5.0-5.4 | Maintien | Pas d'adaptation posologique. |
5.5-5.9 | Diminution | Passer de 50 mg 1x par jour à 25 mg 1x par jour. Passer de 25 mg 1x par jour à 25 mg tous les 2 jours. Passer de 25 mg tous les 2 jours à une pause thérapeutique. |
≥6.0 | Pause thérapeutique | Recommencer par 25 mg tous les 2 jours dès que le potassium est <5.0 mmol/l. |
Patients présentant des troubles de la fonction rénale
Patients atteints d'une insuffisance rénale modérée (TFGe compris entre 30 et 49 ml/min/1.73 m2)
Les patients atteints d'une insuffisance cardiaque de classe II selon la NYHA qui présentent un potassium sérique ≤5 mmol/l doivent recevoir une dose initiale de 25 mg tous les 2 jours. Celle-ci doit être augmentée à la dose cible de 25 mg/jour dans les 4 semaines suivant le début du traitement en fonction du potassium sérique (voir le Tableau 1). La dose maximale est de 25 mg/jour.
On ne dispose d'aucune expérience chez les patients atteints d'une insuffisance cardiaque après un infarctus du myocarde et présentant une clairance de la créatinine <50 ml/min. La prudence est recommandée lors de l'utilisation de l'éplérénone chez ces patients.
Patients atteints d'une insuffisance rénale sévère (TFGe <30 ml/min/1.73 m2)
L'utilisation de l'éplérénone est contre-indiquée chez ces patients.
L'éplérénone n'est pas dialysable.
Patients âgés
Dans l'étude EMPHASIS-HF, n=330 patients de ≥75 ans ont été traités par l'éplérénone. La dose thérapeutique y a été adaptée à la fonction rénale (voir «Propriétés/Effets»). Les patients âgés ont présenté un risque accru d'hyperkaliémie en comparaison des patients plus jeunes. Un contrôle particulièrement régulier du potassium sérique est recommandé.
Enfants et adolescents
Aucune donnée n'est disponible sur l'utilisation de l'éplérénone chez les enfants et les adolescents de moins de 18 ans. En conséquence, l'utilisation dans ce groupe de patients n'est pas recommandée.
Patients recevant des inhibiteurs du CYP3A4
La dose maximale d'éplérénone est de 25 mg/jour chez les patients recevant simultanément des inhibiteurs faibles à modérés du CYP3A4.
La prise concomitante d'inhibiteurs forts du CYP3A4 et d'éplérénone est contre-indiquée (voir «Contre-indications»).
Contre-indications
- Hypersensibilité à l'éplérénone ou à l'un des excipients conformément à la composition.
- Tous les patients présentant une kaliémie >5.0 mmol/l avant l'instauration du traitement.
- Tous les patients présentant une insuffisance rénale sévère (TFGe <30 ml/min/1.73 m²).
- Tous les patients présentant une insuffisance hépatique sévère (Classe Child-Pugh C).
- Tous les patients recevant des diurétiques d'épargne potassique (par ex. spironolactone) ou des inhibiteurs puissants du CYP3A4 (tels que l'itraconazole, le kétoconazole, le ritonavir, le nelfinavir, la clarithromycine) (voir «Interactions»).
- Patients hypertendus traités avec des préparations/des produits de substitution au sel contenant du potassium.
- Association de l'éplérénone avec une double inhibition du système rénine-angiotensine-aldostérone existante (inhibiteur de l'ECA PLUS antagoniste des récepteurs de l'angiotensine II).
Mises en garde et précautions
Hyperkaliémie
En raison du mécanisme d'action de l'éplérénone, des hyperkaliémies peuvent survenir. En conséquence, la kaliémie doit être contrôlée chez tous les patients lors de l'instauration du traitement et lors d'une adaptation posologique. De plus, un contrôle régulier est recommandé chez les patients présentant un risque accru d'hyperkaliémie (patients atteints d'insuffisance rénale, de diabète, patients âgés). Le traitement par éplérénone sera interrompu lorsque la kaliémie atteint des valeurs ≥6.0 mmol/l (voir «Posologie/Mode d'emploi»).
Le risque d'hyperkaliémie peut être augmenté si l'éplérénone est utilisée en association avec un inhibiteur de l'ECA ou un antagoniste des récepteurs de l'angiotensine. L'association d'un inhibiteur de l'ECA et d'un antagoniste des récepteurs de l'angiotensine ne doit pas être utilisée conjointement avec l'éplérénone (voir «Contre-indications» et «Interactions»).
Insuffisance rénale
Chez les patients présentant une insuffisance rénale, y compris une microalbuminurie diabétique, la kaliémie doit être contrôlée régulièrement. Après l'instauration du traitement, la dose sera ajustée en fonction de la kaliémie (voir Tableau 1 sous «Posologie/Mode d'emploi»). Le risque d'hyperkaliémie augmente avec la diminution de la fonction rénale. Les patients présentant un taux de filtration glomérulaire estimé (TFGe) <30 ml/min/1.73 m² ne doivent pas être traités par l'éplérénone. Bien que les données issues de l'étude EPHESUS sur les patients souffrant de diabète de type 2 et de microalbuminurie soient limitées, une incidence accrue de l'hyperkaliémie a été observée chez ce petit nombre de patients. C'est pourquoi ces patients seront traités avec précaution. L'éplérénone n'est pas éliminée par hémodialyse (voir «Posologie/Mode d'emploi» et «Contre-indications»).
Insuffisance hépatique
Chez des patients présentant une insuffisance hépatique légère à modérée (Child-Pugh A et B), aucune augmentation de la kaliémie au-dessus de 5.5 mmol/l n'a été observée. Un contrôle fréquent et régulier de la kaliémie est toutefois recommandé, notamment chez les patients âgés. L'utilisation de l'éplérénone n'a pas été étudiée chez les patients présentant une insuffisance hépatique sévère (Child-Pugh C) (voir «Posologie/Mode d'emploi» et «Contre-indications»).
Anti-inflammatoires non stéroïdiens (AINS)
L'administration simultanée d'autres substances d'épargne potassique et d'AINS a provoqué une baisse de l'effet antihypertenseur ainsi qu'une hyperkaliémie chez les patients présentant une insuffisance rénale (voir «Interactions»).
Inducteurs du CYP3A4
L'administration d'éplérénone avec des inducteurs puissants du CYP3A4 n'est pas recommandée (voir «Interactions»).
Autres médicaments
Le lithium, la ciclosporine et le tacrolimus doivent être évités pendant un traitement par l'éplérénone (voir «Interactions»).
Alpha-bloquants, amifostine, triméthoprime, inhibiteurs de l'ECA et antagonistes des récepteurs de l'angiotensine II (voir ci-dessus: «Hyperkaliémie»), antidépresseurs tricycliques, neuroleptiques, baclofène, glucocorticoïdes, tétracosactide (voir «Interactions»).
Excipients revêtant un intérêt particulier
Les comprimés pelliculés Éplérénone Xiromed à 25 mg et à 50 mg contiennent du lactose monohydraté en tant qu'excipient (respectivement 36.92 mg et 73.85 mg par comprimé). Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne devraient pas prendre ce médicament.
Les comprimés pelliculés d'Éplérénone Xiromed à 25 mg et à 50 mg contiennent moins de 1 mmol (23 mg) de sodium par comprimé (respectivement 0.43 mg et 0.86 mg), c.-à-d. qu'ils sont essentiellement «sans sodium».
Interactions
Interactions pharmacocinétiques
Des études in vitro montrent que l'éplérénone n'est pas un inhibiteur des isoenzymes des CYP1A2, CYP2C19, CYP2C9, CYP2D6 ou CYP3A4. L'éplérénone n'est ni un substrat ni un inhibiteur de la glycoprotéine P.
Inhibiteurs du CYP3A4
- Inhibiteurs puissants du CYP3A4: en raison d'une interaction pharmacocinétique, l'utilisation concomitante d'éplérénone avec des inhibiteurs puissants du CYP3A4 tels que le kétoconazole, l'itraconazole, le ritonavir, le nelfinavir ou la clarithromycine est contre-indiquée (voir «Contre-indications»).
- Inhibiteurs faibles à modérés du CYP3A4: l'administration concomitante d'érythromycine, de saquinavir, d'amiodarone, de diltiazem, de vérapamil ou de fluconazole a provoqué des interactions pharmacocinétiques significatives avec une augmentation de l'ASC allant jusqu'à un facteur 2. En conséquence, la posologie de l'éplérénone ne doit pas dépasser 25 mg/jour en cas d'association à des inhibiteurs faibles à modérés du CYP3A4.
Inducteurs du CYP3A4
L'administration simultanée de millepertuis (inducteur puissant du CYP3A4) et d'éplérénone a provoqué une diminution de 30% de l'ASC de l'éplérénone. Une diminution plus importante de l'ASC de l'éplérénone peut survenir avec des inducteurs du CYP3A4 plus puissants comme la rifampicine. En raison d'un risque de diminution de l'efficacité de l'éplérénone, l'utilisation simultanée de puissants inducteurs du CYP3A4 (rifampicine, carbamazépine, phénytoïne, phénobarbital, millepertuis) et d'éplérénone n'est pas recommandée.
Substrats du CYP3A4
Les résultats d'études pharmacocinétiques avec des substrats de test du CYP3A4, tels que le midazolam et le cisapride, n'ont pas montré d'interactions pharmacocinétiques significatives lorsque ces principes actifs ont été utilisés simultanément à l'éplérénone.
Digoxine
L'ASC de la digoxine augmente de 16% (intervalle de confiance à 90%: 4-30%) en cas d'administration concomitante avec l'éplérénone. La prudence est de rigueur si le taux de digoxine est proche de la limite supérieure thérapeutique.
Warfarine
La prudence est de rigueur si le taux de warfarine se situe près de la limite supérieure thérapeutique.
Interactions pharmacodynamiques
Diurétiques d'épargne potassique, préparations/produits de substitution au sel contenant du potassium
En raison du risque accru d'hyperkaliémie, l'éplérénone ne doit être administrée à aucun patient recevant d'autres diurétiques d'épargne potassique, ni à aucun patient hypertendu recevant des préparations/produits de substitution au sel contenant du potassium (voir «Contre-indications» et «Mises en garde et précautions»). Les diurétiques d'épargne potassique peuvent aussi accentuer l'effet des médicaments antihypertenseurs et des autres diurétiques.
Inhibiteurs de l'ECA, antagonistes des récepteurs de l'angiotensine (ARA)
Le risque d'hyperkaliémie peut être augmenté si l'éplérénone est utilisée en association avec un inhibiteur de l'ECA ou un antagoniste des récepteurs de l'angiotensine. Une surveillance stricte des taux sériques de potassium et de la fonction rénale est notamment recommandée chez les patients présentant une altération préexistante de la fonction rénale. La triple association d'un inhibiteur de l'ECA et d'un antagoniste des récepteurs de l'angiotensine avec l'éplérénone ne doit pas être utilisée (voir «Contre-indications» et «Mises en garde et précautions»).
Lithium
Aucune étude d'interaction médicamenteuse n'a été conduite avec le lithium et l'éplérénone. Cependant, chez des patients recevant du lithium en même temps que des diurétiques et des inhibiteurs de l'ECA, une toxicité du lithium a été rapportée. L'administration concomitante d'éplérénone et de lithium doit être évitée. Si cette association s'avère nécessaire, les concentrations plasmatiques en lithium doivent être étroitement surveillées (voir «Mises en garde et précautions»).
Ciclosporine, Tacrolimus
La ciclosporine et le tacrolimus peuvent entraîner des troubles de la fonction rénale et majorer le risque d'hyperkaliémie. L'utilisation concomitante d'éplérénone et de ciclosporine ou de tacrolimus doit être évitée. Si l'administration de la ciclosporine et du tacrolimus s'avère indispensable durant un traitement par l'éplérénone, un contrôle étroit de la kaliémie et de la fonction rénale est recommandé (voir «Mises en garde et précautions»).
Anti-inflammatoires non stéroïdiens (AINS)
Un traitement par AINS peut entraîner une insuffisance rénale aiguë en agissant directement sur la filtration glomérulaire, en particulier chez les patients à risque (patients âgés et/ou patients déshydratés). Les patients recevant de l'éplérénone et des AINS doivent être correctement hydratés et leur fonction rénale contrôlée avant l'initiation du traitement.
Triméthoprime
L'administration concomitante de triméthoprime et d'éplérénone augmente le risque d'hyperkaliémie. Une surveillance de la kaliémie et de la fonction rénale doit être effectuée en particulier chez les patients atteints d'insuffisance rénale et chez les patients âgés.
Alpha-bloquants (par ex. alfuzosine)
L'association d'alpha-bloquants et d'éplérénone comporte le risque d'accentuer l'effet hypotenseur et/ou une hypotension orthostatique. Un contrôle clinique de l'hypotension orthostatique est recommandé lors d'un traitement concomitant par des alpha-bloquants.
Antidépresseurs tricycliques, neuroleptiques, amifostine, baclofène
Il existe un risque potentiel de majoration des effets antihypertenseurs et d'hypotension orthostatique si ces médicaments sont associés à l'éplérénone.
Glucocorticoïdes, tétracosactide
L'administration simultanée de ces médicaments et de l'éplérénone peut vraisemblablement diminuer l'effet antihypertenseur (rétention sodique et hydrique).
Grossesse/Allaitement
Grossesse
Les données sur l'utilisation de l'éplérénone durant la grossesse sont insuffisantes. L'éplérénone ne doit pas être administrée durant la grossesse, sauf en cas de nécessité absolue.
Allaitement
On ignore si l'éplérénone passe dans le lait maternel après administration orale. Ne pas allaiter en cas d'indication stricte pour l'utilisation de l'éplérénone.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Des vertiges ou des syncopes peuvent survenir au cours du traitement. La prudence est donc de rigueur lors de la conduite automobile ou l'utilisation de machines, jusqu'à la connaissance de la réponse individuelle au traitement.
Effets indésirables
L'incidence globale des effets indésirables et les taux d'interruptions dues aux effets indésirables rapportés dans le cadre de l'utilisation de l'éplérénone ont été similaires à ceux observés sous placebo, aussi bien au cours de l'étude EPHESUS qu'au cours de l'étude EMPHASIS-HF. L'effet indésirable le plus fréquemment signalé dans l'étude EPHESUS et l'étude EMPHASIS-HF était l'hyperkaliémie avec un taux d'incidence de respectivement 3.4% et 8.7% sous éplérénone.
Les effets indésirables sont classés par système d'organe et fréquence absolue. Les fréquences sont définies de la manière suivante: très fréquents (≥1/10), fréquents (≥1/100 à <1/10), occasionnels (≥1/1'000 à <1/100), rares (≥1/10'000 à <1/1'000), très rares (<1/10'000).
Infections et infestations
Fréquents: infection.
Occasionnels: pyélonéphrite, pharyngite.
Affections hématologiques et du système lymphatique
Occasionnels: éosinophilie.
Affections endocriniennes
Occasionnels: hypothyroïdie.
Troubles du métabolisme et de la nutrition
Fréquents: hyperkaliémie, déshydratation.
Occasionnels: hypercholestérolémie, hypertriglycéridémie, hyponatrémie.
Affections psychiatriques
Occasionnels: insomnie.
Affections du système nerveux
Fréquents: vertiges, syncope.
Occasionnels: céphalées, hypoesthésie.
Affections cardiaques
Fréquents: infarctus du myocarde.
Occasionnels: fibrillation auriculaire, insuffisance ventriculaire gauche.
Affections vasculaires
Fréquents: hypotension.
Occasionnels: hypotension orthostatique, thrombose artérielle de la jambe.
Affections respiratoires, thoraciques et médiastinales
Fréquents: toux.
Affections gastro-intestinales
Fréquents: diarrhée, nausée, constipation.
Occasionnels: flatulences, vomissements.
Affections hépatobiliaires
Occasionnels: cholécystite.
Affections de la peau et du tissu sous-cutané
Fréquents: prurit.
Occasionnels: hyperhidrose.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: crampes musculaires, douleurs musculo-squelettiques.
Occasionnels: dorsalgie.
Affections du rein et des voies urinaires
Fréquents: troubles de la fonction rénale.
Troubles généraux
Occasionnels: asthénie, malaise.
Investigations
Fréquents: urée sanguine augmentée.
Occasionnels: créatinine sérique augmentée, diminution de la valeur de l'EGFR (epidermal growth factor receptor), taux de glycémie augmenté.
Dans l'étude EPHESUS, un nombre plus important de cas d'accident vasculaire cérébral a été observé dans le groupe des sujets âgés (≥75 ans) (éplérénone 4.9%, placebo 3.1%, p=0.10). Dans l'étude EMPHASIS-HF, le nombre d'accidents vasculaires cérébraux observés chez les patients âgés (≥75 ans) a été de n=9 (2.7%) dans le groupe éplérénone et de n=8 (2.4%) dans le groupe placebo.
Effets indésirables identifiés après la mise sur le marché
Expériences post-marketing
Depuis la mise sur le marché, les effets indésirables suivants ont également été observés:
Affections de la peau et du tissu sous-cutané: angioœdème, rash.
Affections des organes de reproduction et du sein: gynécomastie.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Aucun cas d'effets indésirables liés à un surdosage d'éplérénone n'a été rapporté chez l'être humain jusqu'ici. La manifestation la plus probable d'un surdosage chez l'être humain est une hypotension et une hyperkaliémie. L'éplérénone ne peut pas être éliminée par hémodialyse. Toutefois, elle se lie de manière importante au charbon activé. En cas d'hypotension symptomatique, un traitement symptomatique doit être instauré. En cas de survenue d'une hyperkaliémie, les mesures de traitement usuelles doivent être mises en œuvre.
Propriétés/Effets
Code ATC
C03DA04
Mécanisme d'action
Voir «Pharmacodynamique».
Pharmacodynamique
L'éplérénone présente une sélectivité relative dans sa fixation aux récepteurs minéralocorticoïdes humains recombinants en comparaison de sa fixation aux récepteurs humains recombinants aux glucocorticoïdes, à la progestérone et aux androgènes. L'éplérénone empêche la fixation de l'aldostérone.
Efficacité clinique
L'éplérénone a été évaluée dans l'étude «Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study» (EPHESUS). EPHESUS est une étude multicentrique, en double aveugle et contrôlée par placebo, menée chez n=6632 patients (moyenne du suivi: 16 mois) ayant eu un infarctus du myocarde aigu, présentant une dysfonction ventriculaire gauche (avec une fraction d'éjection ventriculaire gauche [FEVG] ≤40%) et des signes cliniques d'insuffisance cardiaque. L'inclusion des patients après randomisation dans l'étude EPHESUS a eu lieu dans les 3 à 14 jours suivant la pose du diagnostic d'infarctus du myocarde. La durée moyenne jusqu'à l'inclusion était de 7 jours. En raison du risque cardiovasculaire accru associé au diabète, les patients diabétiques présentant une dysfonction ventriculaire gauche et sans symptômes d'insuffisance cardiaque ont été inclus dans l'étude; 10% de la population de l'étude remplissait ce critère. En plus d'un traitement standard, les patients ont reçu de l'éplérénone ou un placebo à une dose initiale de 25 mg une fois par jour, avec augmentation de la posologie en l'espace de 4 semaines jusqu'à la dose d'entretien de 50 mg une fois par jour si la kaliémie était <5.0 mEq/l. Pendant l'étude, les patients ont reçu un traitement standard comportant de l'aspirine (92%), des inhibiteurs de l'ECA (90%), des bêtabloquants (83%), des dérivés nitrés (72%), des diurétiques de l'anse (66%) ou des inhibiteurs de la HMG-CoA réductase (60%).
Dans l'étude EPHESUS, les critères primaires d'évaluation étaient la mortalité toutes causes confondues et un critère combiné de mortalité cardiovasculaire ou d'hospitalisation d'origine cardiovasculaire. 14.4% des patients recevant l'éplérénone et 16.7% des patients recevant le placebo sont décédés (toutes causes confondues), alors que 26.7% des patients recevant l'éplérénone et 30.0% des patients recevant le placebo ont présenté le critère combiné de mortalité cardiovasculaire ou d'hospitalisation d'origine cardiovasculaire. Ainsi, dans l'étude EPHESUS, l'éplérénone a réduit le risque de mortalité toutes causes confondues de 15% (réduction du risque absolu 2.3%, RR 0.85; intervalle de confiance à 95%, 0.75-0.96; p=0.008; NNT: 43) en comparaison du placebo, essentiellement en réduisant la mortalité cardiovasculaire. Le risque de mortalité cardiovasculaire ou d'hospitalisation d'origine cardiovasculaire a été réduit de 13% avec l'éplérénone (réduction du risque absolu 3.3%; RR 0.87; intervalle de confiance à 95%, 0.79-0.95; p=0.002; NNT: 31).
L'efficacité clinique d'un traitement par éplérénone a été démontrée essentiellement lorsque les patients étaient <75 ans. Les bénéfices du traitement chez les patients ≥75 ans sont incertains. La classification fonctionnelle de NYHA s'est améliorée ou est restée stable (p<0.001) pour une proportion significativement plus élevée de patients traités par éplérénone (n=2'372 patients, 75.3%) par rapport au groupe placebo (n=2242 patients, 71.3%).
Figure 1: Rapport des risques pour toutes les causes de mortalité par sous-groupe

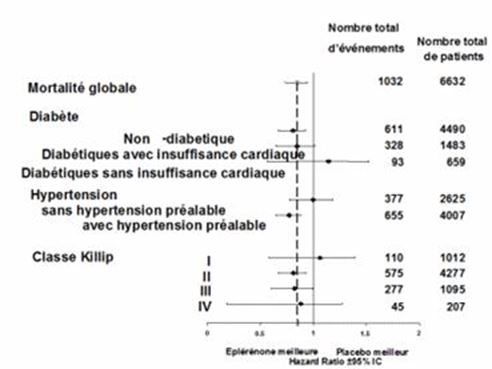


Dans l'étude EMPHASIS-HF (Eplerenone in Mild Patients Hospitalization and Survival Study in Heart Failure), l'éplérénone a été évaluée en complément à un traitement standard chez des patients présentant une insuffisance cardiaque systolique et des symptômes légers (classe fonctionnelle II selon la NYHA). Aucun patient des classes fonctionnelles III et IV selon la NYHA n'a été évalué dans l'étude.
Les patients inclus dans l'étude avaient ≥55 ans et présentaient une fraction d'éjection ventriculaire gauche (FEVG) ≤30% ou une FEVG ≤35% et en plus une durée du QRS >130 msec. En outre, les participants à l'étude devaient soit avoir été hospitalisés dans les 6 mois précédents pour une cause cardiovasculaire (CV), soit présenter un taux plasmatique de BNP ≥250 pg/ml ou un taux de pro-BNP ≥500 pg/ml (hommes) ou ≥750 pg/ml (femmes). Le traitement par l'éplérénone a été commencé à la posologie de 25 mg une fois par jour, posologie qui a été augmentée à 50 mg une fois par jour après 4 semaines dans la mesure où les taux sériques de potassium étaient <5.0 mmol/l et le TFGe ≥50 ml/min. Comme alternative, si le taux de filtration glomérulaire estimé était compris entre 30 et 49 ml/min/1.73 m2, le traitement par l'éplérénone a été commencé à la posologie de 25 mg tous les 2 jours, posologie qui a pu être augmentée à 25 mg une fois par jour.
Les médicaments cardiovasculaires les plus fréquemment associés à l'éplérénone ou au placebo chez l'ensemble des n=2737 participants à l'étude ont été des diurétiques (85%), des inhibiteurs de l'ECA (78%), des antagonistes des récepteurs de l'angiotensine II (19%), des bêtabloquants (87%), des médicaments antithrombotiques (88%), des hypolipémiants (63%) et des alcaloïdes de la digitale (27%). La FEVG moyenne était de 26% et la durée moyenne du QRS était d'environ 122 msec. La plupart des patients (83.4%) avaient été hospitalisés pour des causes cardiovasculaires dans les 6 derniers mois précédant la randomisation et env. 50% pour une insuffisance cardiaque. Environ 20% des patients étaient pourvus d'un défibrillateur implanté ou bénéficiaient d'un traitement de resynchronisation cardiaque.
Le critère d'évaluation principal (décès d'origine cardiovasculaire ou hospitalisation pour insuffisance cardiaque) a été observé chez n=249 patients (18.3%) du groupe éplérénone et chez n=356 patients (25.9%) du groupe placebo (RR 0.63, IC à 95%, 0.54-0.74; p<0.001). Ce résultat a été cohérent dans tous les sous-groupes étudiés.
Le critère d'évaluation secondaire, à savoir la mortalité toutes causes confondues, a été observé chez n=171 patients (12.5%) du groupe éplérénone et chez n=213 patients (15.5%) du groupe placebo (RR 0.76; IC à 95%, 0.62-0.93; p=0.008). Un décès d'origine cardiovasculaire a été rapporté chez n=147 patients (10.8%) du groupe éplérénone et chez n=185 patients (13.5%) du groupe placebo (RR 0.76; IC à 95%, 0.61-0.94; p=0.01).
Une hyperkaliémie (taux sérique de potassium >5.5 mmol/l) a été rapportée au cours de l'étude chez n=158 patients (11.8%) du groupe éplérénone et chez n=96 patients (7.2%) du groupe placebo (p<0.001). Une hypokaliémie, définie comme un taux sérique de potassium <4.0 mmol/l, est survenue plus rarement avec l'éplérénone qu'avec le placebo (38.9% avec l'éplérénone en comparaison de 48.4% avec le placebo, p<0.0001).
Pharmacocinétique
Absorption
La biodisponibilité absolue de l'éplérénone est de 69%. Les concentrations plasmatiques maximales sont atteintes environ 1.5-2 h après la prise orale d'éplérénone. L'absorption au niveau de la partie terminale de l'iléon et du côlon a lieu avec un retard de 3 à 4 h. Les pics plasmatiques (Cmax) et l'aire sous la courbe (ASC) sont proportionnels à la dose dans l'intervalle de doses allant de 10 mg à 100 mg, et moins proportionnels aux doses supérieures à 100 mg. L'absorption n'est pas influencée par les aliments.
Distribution
La liaison de l'éplérénone aux protéines plasmatiques est d'environ 50% et a lieu essentiellement avec l'alpha 1-glycoprotéine acide. Le volume de distribution apparent à l'état d'équilibre est estimé à 42-90 l. L'éplérénone ne se fixe pas de manière préférentielle sur les hématies.
Métabolisme
L'éplérénone est métabolisée principalement par le cytochrome P450 (CYP) 3A4. Aucun métabolite actif de l'éplérénone n'a été identifié dans le plasma humain.
Élimination
La demi-vie d'élimination se situe entre 4-6 h. La clairance plasmatique apparente est d'environ 10 l/h. L'état d'équilibre est atteint en 2 jours. Moins de 5% d'une dose d'éplérénone sont retrouvés sous forme inchangée dans les urines et les fèces. Après une dose orale unique d'éplérénone radiomarquée, environ 32% de la dose sont excrétés dans les fèces et environ 67% dans les urines.
Cinétique pour certains groupes de patients
Âge, sexe et race
La pharmacocinétique de l'éplérénone n'était pas significativement différente entre les hommes et les femmes. À l'état d'équilibre, des augmentations de la Cmax (22%) et de l'ASC (45%) ont été observées chez les personnes âgées par rapport aux volontaires plus jeunes (18 à 45 ans). À l'état d'équilibre, la Cmax a été inférieure de 19% et l'ASC de 26% chez les sujets à la peau noire (voir «Posologie/Mode d'emploi»).
Troubles de la fonction hépatique
La pharmacocinétique de l'éplérénone à la posologie de 400 mg a été étudiée chez des patients atteints d'insuffisance hépatique modérée (Child-Pugh B) et comparée à celle de volontaires sains. La Cmax à l'état d'équilibre était augmentée de 3.6% et l'ASC de 42% (voir «Posologie/Mode d'emploi»).
Troubles de la fonction rénale
La pharmacocinétique de l'éplérénone a été évaluée chez des patients présentant des degrés variables d'insuffisance rénale et chez des patients sous hémodialyse. Par rapport aux volontaires sains, l'ASC à l'état d'équilibre était augmentée de 38% et la Cmax de 24% chez les patients atteints d'insuffisance rénale sévère, et diminuées de 26% et 3% respectivement chez les patients sous hémodialyse. Aucune corrélation entre la clairance plasmatique de l'éplérénone et la clairance de la créatinine n'a été observée. L'éplérénone n'est pas éliminée par hémodialyse (voir «Mises en garde et précautions»).
Insuffisance cardiaque
La pharmacocinétique de l'éplérénone à la posologie de 50 mg a été étudiée chez des patients souffrant d'insuffisance cardiaque (classification II-IV de la NYHA). Par rapport aux volontaires sains d'âge, de poids et de sexe identiques, l'ASC à l'état d'équilibre était augmentée de 38% et la Cmax de 30% chez les patients atteints d'insuffisance cardiaque. Conformément à ces résultats, une analyse pharmacocinétique de population basée sur un sous-ensemble de patients de l'étude EPHESUS a montré que la clairance de l'éplérénone chez les patients atteints d'insuffisance cardiaque était similaire à celle de volontaires âgés sains.
Données précliniques
Les investigations précliniques de sécurité pharmacologique, de toxicité en administration répétée, de génotoxicité, de carcinogénicité et de toxicité pour la reproduction n'ont pas révélé de risque particulier pour l'homme.
Les études menées chez le rat et le lapin n'ont pas montré d'effet tératogène. Toutefois, une baisse du poids corporel et une augmentation des résorptions fœtales ainsi qu'une augmentation des avortements (perte après nidation) ont été observées chez les lapines à la plus haute dose appliquée. Le risque potentiel pour l'être humain est inconnu.
Des données précliniques montrent que l'éplérénone et/ou ses métabolites sont présents dans le lait maternel des rates.
Dans les études de toxicologie en administration répétée menées chez le rat et le chien, une atrophie de la prostate a été observée à des niveaux d'exposition de plusieurs fois supérieurs aux niveaux d'exposition clinique. Les modifications de la prostate n'étaient pas accompagnées de conséquences fonctionnelles délétères. La signification clinique de ces résultats est incertaine.
Remarques particulières
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30°C. Conserver dans l'emballage d'origine. Conserver hors de portée des enfants.
Numéro d’autorisation
68283 (Swissmedic).
Titulaire de l’autorisation
Xiromed SA, 6330 Cham.
Mise à jour de l’information
Septembre 2020.
Отзывов (0)

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.





 Deutsch
Deutsch French
French Italian
Italian