Актемра (тоцилизумаб) инфузионный концентрат 400 мг / 20 мл флакон 20 мл
Actemra 400 mg/20 ml
-
136284.72 RUB
Предполагаемая дата доставки:
17.12.2025 - 31.12.2025
При оплате криптовалютой:
Ваша прибыль 13628.47 RUB / 157.90 USDT
- Наличие: В наличии
- Производитель: ROCHE PHARMA (SCHWEIZ
- Модель: 4038181
- ATC-код L04AC07
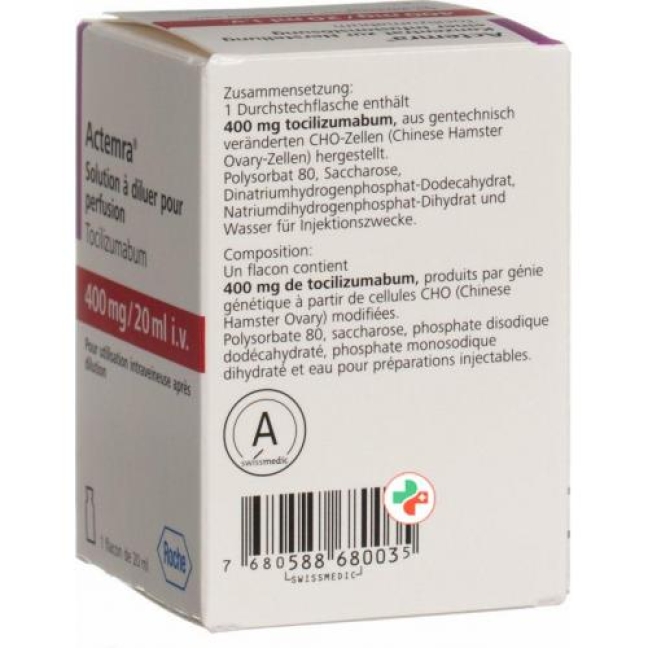
- EAN 7680588680035
Описание
состав
Активные ингредиенты:
Тоцилизумаб.
Наполнители:
Концентрат для приготовления раствора для инфузий
Сахароза, полисорбат 80, додекагидрат фосфата динатрия, дигидрат дигидрофосфата натрия, вода для инъекций.
Раствор для инъекций для подкожного применения
L-гистидин, L-гистидин гидрохлорид моногидрат, L-аргинин, L-аргинин гидрохлорид, L-метионин, полисорбат 80, вода для инъекций.
Лекарственная форма и количество активного ингредиента на единицу
Концентрат для приготовления раствора для инфузий:
- Каждый флакон объемом 4 мл содержит 80 мг тоцилизумаба (20 мг / мл).
- Каждый флакон на 10 мл содержит 200 мг тоцилизумаба (20 мг / мл).
- Каждый флакон объемом 20 мл содержит 400 мг тоцилизумаба (20 мг / мл).
Раствор для инъекций для подкожного применения:
- Предварительно заполненный шприц объемом 0,9 мл содержит 162 мг тоцилизумаба (180 мг / мл).
- Каждая 0,9 мл предварительно заполненная ручка содержит 162 мг тоцилизумаба (180 мг / мл).
Показания / возможные применения
Ревматоидный артрит (РА) [IV и SC фармацевтические формы]
Актемра показана для лечения взрослых пациентов с активным ревматоидным артритом от средней до тяжелой степени, которые не ответили адекватно на побочные эффекты лечения модифицирующими болезнь противовоспалительными препаратами (DMARD), включая метотрексат (MTX). Актемру можно вводить в виде монотерапии или, альтернативно, в сочетании с csDMARD (обычными синтетическими DMARD), включая MTX. Замедление прогрессирования структурного повреждения и улучшение физической функции были показаны при комбинированной терапии с метотрексатом.
Ревматоидный артрит (РА) [внутривенная лекарственная форма]
У нелеченных пациентов с ревматоидным артритом от умеренной до тяжелой степени улучшение контроля над симптомами и признаками ревматоидного артрита и замедление прогрессирования структурного повреждения с помощью Актемры были показаны как в комбинированной терапии с метотрексатом, так и в монотерапии (см. В разделе «Свойства / эффекты») ,
Гигантоклеточный артериит (РЗА) [подкожная лекарственная форма]
Актемра показана в сочетании с конусной терапией глюкокортикоидами для лечения гигантоклеточного артериита (РЗА) у взрослых пациентов, которым не требуется более 60 мг преднизона (или эквивалентного активного ингредиента) в день для начала приема Актемры.
Полиартикулярный ювенильный идиопатический артрит (pJIA) [внутривенные и подкожные лекарственные формы]
Актемра в комбинации с метотрексатом показана для лечения активного полиартикулярного ювенильного идиопатического артрита у пациентов в возрасте от 2 лет и старше, у которых был недостаточный ответ на метотрексат. Если вы не переносите метотрексат, Актемру можно назначать в качестве монотерапии.
Системный ювенильный идиопатический артрит (sJIA) [внутривенные и подкожные лекарственные формы]
Внутривенная лекарственная форма
Лечение детей и подростков от 2 лет с системным ювенильным идиопатическим артритом, которые неадекватно отреагировали на предшествующую терапию нестероидными противовоспалительными препаратами и стероидами. Актемра применялась в клинических исследованиях в сочетании с кортикостероидами и DMARD, включая метотрексат. Опыт применения Актемры монотерапии без кортикостероидов ограничен.
Подкожная лекарственная форма
Лечение детей и подростков от 1 года с системным ювенильным идиопатическим артритом, которые недостаточно ответили на предшествующую терапию нестероидными противовоспалительными препаратами и стероидами. Актемра применялась в клинических исследованиях в сочетании с кортикостероидами и DMARD, включая метотрексат. Опыт применения Актемры монотерапии без кортикостероидов ограничен.
Синдром высвобождения цитокинов (CRS) [только лекарственная форма IV]
Актемра показана для лечения взрослых и детей в возрасте от 2 лет и старше с тяжелым или опасным для жизни синдромом выброса цитокинов (CRS), индуцированным Т-клетками с рецептором химерного антигена (CAR).
Дозировка / применение
Общая информация
Внутривенная (в/в) лекарственная форма
Лекарственная форма Актемра в/в не предназначена для подкожного введения.
Лечение Актемрой должно начинаться и проводиться под наблюдением врача, имеющего опыт лечения пациентов с ревматоидным артритом (см. «Предупреждения и меры предосторожности»).
Актемра должна быть разбавлена в асептических условиях медицинским работником стерильным 0,9% (вес / объем) раствором хлорида натрия (см. «Другая информация», «Инструкции по обращению»).
Рекомендуемая продолжительность инфузии составляет один час.
Подкожная (подкожная) лекарственная форма
Препарат Актемра не предназначен для внутривенного введения.
Лекарственная форма Актемра вводится с помощью одноразового предварительно заполненного шприца с игольным предохранительным устройством или предварительно заполненной ручкой. Предварительно заполненную ручку не следует использовать для лечения детей в возрасте до 12 лет из-за потенциального риска внутримышечного введения из-за более тонкого подкожного слоя ткани. Первая инъекция должна быть сделана под наблюдением обученного медицинского работника. Пациенты должны получить карточку пациента. Пациенты могут вводить Актемру самостоятельно только в том случае, если врач считает это целесообразным, пациент соглашается на необходимое медицинское наблюдение и получает инструкции по правильной технике инъекции.
Рекомендуемые места инъекции (живот, бедра и плечи) следует менять каждый раз, и никогда не следует делать инъекции родимым пятнам, шрамам или областям с чувствительной, поврежденной, покрасневшей, закаленной или неповрежденной кожей. Пациентам, переходящим от внутривенного лечения тоцилизумабом к подкожному введению, следует вводить первую подкожную дозу во время следующей запланированной внутривенной дозы под наблюдением обученного медицинского работника.
Для применения sc в домашних условиях необходимо оценить пригодность пациента, родителя или опекуна. Пациенты, родители или лица, обеспечивающие уход, должны быть проинструктированы проинформировать медицинского работника до введения следующей дозы, если они или пациент испытывают симптомы аллергической реакции. Если симптомы серьезной аллергической реакции развиваются, пациентам следует немедленно обратиться за медицинской помощью (см. «Предупреждения и меры предосторожности» и «Нежелательные эффекты»).
Чтобы обеспечить отслеживаемость биотехнологически произведенных лекарств, рекомендуется документировать торговое название и номер партии для каждой обработки.
Взрослые (ревматоидный артрит) [лекарственные формы IV и SC]
У взрослых с РА Актемру можно вводить внутривенно или подкожно.
График внутривенного дозирования
Рекомендуемая доза Актемра составляет 8 мг / кг массы тела и вводится один раз каждые 4 недели в виде внутривенной инфузии в течение 1 часа.
Пациенты с весом более 100 кг (кг) не должны получать более 800 мг на разовую дозу.
Схема подкожного дозирования
Рекомендуемая доза Актемра для взрослых пациентов составляет 162 мг в виде подкожной инъекции один раз в неделю. У пациентов с массой тела <60 кг и комедийным приемом метотрексата начальная доза составляет 162 мг каждые 2 недели (см. Также исследование SC-II в разделе «Свойства / эффекты» ниже). В случае недостаточного ответа дозу можно увеличить до 162 мг один раз в неделю.
У пациентов с клиническим ответом на еженедельную дозу Актемры 162 мг в сочетании с метотрексатом следует рассмотреть снижение дозы до 162 мг каждые 2 недели через 12 недель. Снижение дозы у монотерапевтических пациентов с еженедельным дозированием не рекомендуется.
У пациентов с недостаточным ответом при подкожном введении 162 мг в неделю и массе тела> 100 кг следует рассмотреть возможность перехода на внутривенное введение Актемры 800 мг каждые 4 недели.
Гигантоклеточный артериит (РЗА) [только лекарственная форма]
Все пациенты должны были начать стероидную терапию до начала терапии Актемрой, и перед началом терапии Актемрой доза должна быть снижена до преднизон-эквивалента <60 мг. «Де ново» терапия Актемрой с одновременным началом стероидной терапии не исследована. Следует также иметь в виду, что Актемра не оказывает какого-либо влияния на глазные проявления RZA и что эти пациенты с глазными проявлениями должны лечиться стероидами в соответствии с медицинским заключением и применимыми руководящими принципами.
Пациенты с началом РЗА
Дозировка у пациентов с первым проявлением РЗА:
- подкожно, 162 мг каждые 2 недели , в сочетании с глюкокортикоидным циклом с увеличением дозы
Пациенты с рецидивом РЗА
Дозировка у пациентов с рецидивами STA:
- подкожно, 162 мг, один раз в неделю , в сочетании с глюкокортикоидным циклом с увеличением дозы
Продолжение терапии у всех пациентов
После окончания глюкокортикоидного цикла монотерапию Актемрой можно продолжать в течение 52 недель.
У пациентов, у которых развивается рецидив STC во время терапии Актемрой, лечащий врач должен рассмотреть вопрос о повторном запуске и / или лечении глюкокортикоидами (если это уже было прекращено) в соответствии с рекомендациями медицинского суждения / лечения Увеличьте дозу.
Дети и подростки: 2-18 лет (полиартикулярный ювенильный идиопатический артрит (pJIA)) [лекарственные формы внутривенно и подкожно]
У пациентов с pJIA Актемру назначают в виде внутривенного вливания или подкожной инъекции. Дозу следует изменять только на основании соответствующего изменения массы тела пациента с течением времени. Тоцилизумаб можно использовать отдельно или в комбинации с метотрексатом.
График внутривенного дозирования
Рекомендуемая доза составляет 8 мг / кг массы тела один раз каждые четыре недели (внутривенная инфузия в течение часа).
У пациентов до 30 кг, которые не ответили на рекомендуемую стандартную дозу 8 мг / кг через 8 недель, дозу можно увеличить до 10 мг / кг.
Ограниченные данные доступны у пациентов в возрасте до 5 лет.
Схема подкожного дозирования (см. Предупреждение о подкожном применении Актемры у детей с pJIA)
Рекомендуемая доза составляет 162 мг:
- один раз каждые три недели для пациентов <30 кг массы тела
- один раз каждые две недели для пациентов ≥30 кг массы тела.
Предварительно заполненный шприц с защитным приспособлением для иглы можно использовать для лечения детей любого возраста. Предварительно заполненную ручку не следует использовать для лечения детей младше 12 лет.
Дети и подростки: от 2 до 18 лет [iv лекарственная форма] или 1-18 лет [sc фармацевтическая форма] (системный ювенильный идиопатический артрит (sJIA))
У пациентов с sJIA Актемра вводится в виде внутривенного вливания или подкожной инъекции. Изменение дозы должно основываться только на постоянном изменении массы тела пациента с течением времени. Тоцилизумаб можно использовать отдельно или в комбинации с МТХ.
График внутривенного дозирования
Рекомендуемая доза внутривенного тоцилизумаба у пациентов с sJIA составляет:
- 12 мг / кг у пациентов весом до 30 кг
- 8 мг / кг у пациентов ≥30 кг массы тела
один раз каждые две недели (внутривенное вливание в течение часа).
Схема подкожного дозирования
Рекомендуемая доза тоцилизумаба у пациентов с sJIA составляет:
- 162 мг один раз в две недели у пациентов весом менее 30 кг и не менее 10 кг.
- 162 мг один раз в неделю у пациентов весом ≥30 кг.
Предварительно заполненный шприц с игольным предохранительным устройством можно использовать для лечения детей всех возрастов. Предварительно заполненную ручку не следует использовать для лечения детей младше 12 лет.
Синдром высвобождения цитокинов (CRS) (для взрослых и детей) [внутривенная лекарственная форма]
Рекомендуемая доза для лечения CRS путем внутривенной инфузии в течение 60 минут составляет 8 мг / кг для пациентов весом 30 кг или 12 мг / кг для пациентов весом менее 30 кг. Актемру можно назначать отдельно или в комбинации с кортикостероидами.
Если после первой дозы не наблюдается клинического улучшения признаков и симптомов CRS, можно назначить до 3 доз препарата Актемра. Между каждой дозой должен быть интервал не менее 8 часов. Дозы выше 800 мг на одну инфузию не рекомендуются пациентам с ХБС.
Пациенты с тяжелым или опасным для жизни CRS часто имеют цитопению или повышенные уровни ALT или AST из-за лежащей в основе злокачественной опухоли, которая предшествует химиотерапии по поводу лимфодеплеции или CRS.
Специальные инструкции по дозировке
Пациенты с печеночной недостаточностью
Актемра не изучалась у пациентов с печеночной недостаточностью.
Пациенты с почечной дисфункцией
Коррекция дозы не требуется для пациентов с легкой или умеренной почечной недостаточностью. Актемра не изучалась у пациентов с почечной недостаточностью средней и тяжелой степени.
Пожилые пациенты (≥65 лет)
Коррекция дозы не требуется.
Дети и подростки
Безопасность и эффективность Actemra у пациентов с pJIA в возрасте до 2 лет не были изучены. Безопасность и эффективность Актемра в/в у пациентов с sJIA в возрасте до 2 лет и Actemra sc у пациентов с sJIA в возрасте до 1 года не изучались. Актемра у детей и подростков с заболеваниями суставов, кроме pJIA или sJIA, не изучалась.
Пациенты с повышенным уровнем трансаминаз
Изменения в лабораторных значениях часто наблюдаются с Actemra, которые требуют корректировки дозировки:
Терапия Актемра следует начинать с осторожностью у пациентов с повышенными уровнями трансаминаз (АЛТ или АСТ более 1,5х ULN). Пациенты с повышенным уровнем АЛТ или АСТ> 5х ULN не должны получать Актемру.
Для RA, RZA, pJIA и sJIA значения ALT / AST следует проверять каждые 4-8 недель в первые 6 месяцев лечения, а затем каждые 12 недель после этого.
Для повышения ALT или AST> 1 до 3x ULN рекомендуется корректировка дозы одновременно вводимых обычных DMARD, таких как MTX, лефлуномид, сульфасалазин.
Пациенты, получавшие внутривенную Актемру:
Для увеличения> 1 до 3х ULN, которые сохраняются, несмотря на эти меры, следует скорректировать дозу Актемры, чтобы добиться нормализации значений ALT / AST (снижение дозы Актемры до 4 мг / кг или прекращение лечения до нормализовать значения ALT / AST, затем возобновить лечение в дозе 4 мг / кг или 8 мг / кг, если это клинически возможно).
Пациенты, получавшие подкожную Актемру:
При постоянно увеличивающихся значениях в этом диапазоне ритм инъекций следует снижать до одного раза в две недели или лечение тоцилизумабом следует прервать до тех пор, пока значения ALT / AST не нормализуются. Лечение может быть возобновлено еженедельными или двухнедельными инъекциями, если это клинически возможно.
Для значений ALT / AST от> 3 до 5x ULN, подтвержденных несколькими измерениями, лечение Актемрой следует прервать. Как только трансаминазы пациента достигают значения <3x ULN, лечение Актемрой можно возобновить с дозы 4 мг / кг или 8 мг / кг массы тела.
Пациенты со сниженным уровнем нейтрофилов или тромбоцитов
РА / РЗА
Лечение не рекомендуется для пациентов с абсолютным количеством нейтрофилов <0,5 x 10 9 / л или количеством тромбоцитов <50 x 10 9 / л, или Актемру следует прекратить.
Количество нейтрофилов и тромбоцитов следует контролировать через 4-8 недель после начала лечения, а затем по усмотрению лечащего врача.
нейтрофилы
Если количество нейтрофилов падает ниже 1x 10 9 / л, но все еще остается выше 0,5x 10 9 / л, лечение следует прервать.
Регулировка дозы с в/в Актемра:
Как только количество нейтрофилов снова возрастает до более чем 1 × 10 9 / л, лечение можно возобновить с уменьшенной дозой 4 мг / кг массы тела. Рекомендуется вернуться к дозе 8 мг / кг массы тела, если это клинически возможно.
Регулировка дозы с помощью п/к Актемры:
Если количество нейтрофилов падает ниже 1x 10 9 / л, но все еще остается выше 0,5x 10 9 / л, лечение следует прервать. Как только количество нейтрофилов снова возрастает до более чем 1 × 10 9 / л, лечение может быть возобновлено с двухнедельным ритмом инъекции, и это может быть увеличено до одного раза в неделю, если это клинически возможно.
тромбоциты
Если количество тромбоцитов падает ниже 100 х 10 9 л падение /, но все еще выше 50x 10 9 / л остается, лечение должно быть прервано.
Регулировка дозы с в/в Актемра:
Как только количество тромбоцитов снова возрастает до более чем 100 × 10 9 / л, лечение можно возобновить с уменьшенной дозой 4 мг / кг массы тела. Рекомендуется вернуться к дозе 8 мг / кг массы тела, если это клинически возможно.
Регулировка дозы с помощью п/к Актемры
Как только количество тромбоцитов снова возрастает до более чем 100 × 10 9 / л, лечение можно возобновить с двухнедельным ритмом инъекции и увеличить до одного раза в неделю, если это клинически возможно.
PJIA / SJIA
Лечение не рекомендуется для пациентов с абсолютным количеством нейтрофилов <0,5 x 10 9 / л или количеством тромбоцитов <50 x 10 9 / л, или Актемру следует прекратить.
Решение о прекращении приема Актемры у пациентов с pJIA / sJIA из-за аномальных лабораторных показателей должно основываться на медицинском осмотре отдельного пациента.
У пациентов с pJIA и sJIA, нейтрофильные гранулоциты должны контролироваться во время второго введения, а затем по усмотрению лечащего врача.
нейтрофилы
Регулировка дозы для п/к и в/в Actemra
Если количество нейтрофилов падает ниже 1x 10 9 / л, но все еще остается выше 0,5x 10 9 / л, лечение следует прервать. Как только количество нейтрофилов снова возрастет до 1 × 10 9 / л, лечение можно возобновить.
тромбоциты
Если количество тромбоцитов падает ниже 100 х 10 9 л падение /, но все еще выше 50x 10 9 / л остается, лечение должно быть прервано.
Доза МТХ, вводимая в одно и то же время, может нуждаться в корректировке.
Регулировка дозы для п/к и в/в Актемры
Как только количество тромбоцитов превысит 100 х 10 9 / л, лечение можно возобновить.
Противопоказания
Актемра противопоказана в случаях повышенной чувствительности к действующему веществу или к одному из вспомогательных веществ в зависимости от состава.
Комбинация с ингибиторами TNF-альфа: одновременно и до 1 месяца после лечения антителами против TNF.
Предупреждения и меры предосторожности
инфекции
Серьезные и в некоторых случаях смертельные инфекции наблюдались у пациентов, получавших иммунодепрессанты, включая тоцилизумаб.
Актемру не следует назначать пациентам с активными инфекциями. Пациентов с рецидивирующими инфекциями или пациентов, страдающих от основных заболеваний, которые способствуют возникновению инфекций (например, дивертикулит, диабет и интерстициальные заболевания легких), следует лечить с осторожностью.
У пациентов, получающих иммунодепрессанты, такие как Актемра, от умеренной до тяжелой РА, pJIA или sJIA, RZA, рекомендуется повышенная осведомленность, чтобы своевременно идентифицировать серьезную инфекцию, поскольку есть признаки и симптомы острого воспаления из-за подавления острой фазы Реактивы могут быть ослаблены. При обследовании пациента на наличие подозрений на инфекцию учитывайте влияние ингибирования IL-6 на С-реактивный белок (СРБ) и нейтрофилы. За счет ингибирования IL-6 ответ на инфекцию может быть ослаблен с точки зрения концентрации СРБ и количества нейтрофилов. Пациенты (включая детей младшего возраста,
подавление иммунитета
Актемра может влиять на гуморальный иммунный ответ.
Осложнения дивертикулита
Сообщалось о случаях дивертикулярной перфорации как осложнения дивертикулита у взрослых, получавших Актемру. Тоцилизумаб следует использовать с осторожностью у пациентов с язвой кишечника или дивертикулитом в анамнезе. Если возникает острая боль в животе, пациент должен быть обследован немедленно, чтобы желудочно-кишечная перфорация могла быть распознана рано.
туберкулез
Как рекомендуется для других биологических методов лечения, все пациенты должны быть обследованы на предмет скрытой туберкулезной инфекции до начала терапии Актемрой. Пациенты с латентным туберкулезом должны проходить стандартную противогрибковую терапию перед началом терапии Актемрой.
Реакции гиперчувствительности
Серьезная гиперчувствительность и анафилаксия произошли после запуска, включая смертельные случаи. Это произошло у пациентов, получавших различные дозы Актемры с сопутствующей терапией артрита или без нее, премедикацией или предшествующей реакцией гиперчувствительности. Некоторые из этих событий произошли, когда Актемра была впервые введена.
Анафилактические реакции могут проявляться, в частности, в виде симптомов кровообращения, бронхообструкции, ангионевротического отека (возможно, дыхательных путей), абдоминальных или кожных симптомов (крапивница, эритема, зуд). Перед тем, как дать Актемру, следует спросить пациентов, имели ли они такие симптомы или другие нежелательные эффекты от предыдущих вливаний и как они имели последнее. Кроме того, следует обеспечить наличие соответствующих неотложных методов лечения анафилактической реакции и выполнение требований к персоналу. Пациенты должны тщательно контролироваться во время и после вливания. Если происходят анафилактические или другие серьезные реакции гиперчувствительности,
Если подкожное применение препарата рассматривается без медицинского наблюдения, пациенты должны быть проинформированы о возможных симптомах реакции гиперчувствительности до начала терапии. Для этой цели Roche предоставляет различные учебные и информационные брошюры для специалистов и пациентов (паспорт пациента, брошюра для пациента и брошюра для врача). Если возникают реакции гиперчувствительности, пациенты должны немедленно сообщить своему врачу и, при необходимости, обратиться за неотложной помощью.
гепатотоксичность
Трансаминазы могут увеличиваться во время лечения Актемрой, особенно если препарат вводят с МТХ. Поэтому Актемру следует использовать с осторожностью при лечении пациентов с активным заболеванием печени или недостаточностью.
Во время лечения Актемрой наблюдались трансаминазы (АЛТ или АСТ) с легким и умеренным рецидивом, иногда рецидивирующим (см. «Нежелательные эффекты»). При использовании лекарственных средств, которые, как известно, являются токсичными для печени (например, метотрексат (MTX)), наблюдается увеличение частоты таких повышенных значений в сочетании с тоцилизумабом.
Актемра наблюдалась серьезное лекарственное повреждение печени, включая острую печеночную недостаточность, гепатит и желтуху (см. «Нежелательные эффекты»). Серьезное повреждение печени произошло от 2 недель до более 5 лет после начала приема Актемры. Известны случаи печеночной недостаточности, когда требуется пересадка печени.
Рекомендации по корректировке дозы, включая прекращение приема Актемры, у пациентов с повышенным уровнем трансаминаз см. В главе «Дозировка / применение, специальные инструкции по дозировке».
Реактивация гепатита В
В редких случаях реактивация гепатита В наблюдалась при использовании иммуносупрессивной терапии при ревматоидном артрите. На сегодняшний день нет подтвержденных данных о том, что реактивация гепатита В может быть исключена у пациентов, получавших Актемру.
вакцинаций
Живые и аттенуированные живые вакцины не следует вводить одновременно с Актемрой, поскольку клинические данные о безопасности отсутствуют.
Нет данных о вторичной передаче инфекции от людей, получавших живую вакцину, пациентам, получавшим Актемру. Нет достоверных данных о виремии или влиянии реакций на вакцинацию после активных прививок. Ответ антител на вакцинацию может быть затронут.
Клиническое исследование у 91 пациента показало, что иммунный ответ на 12 пневмококковых антигенов, исследованных после вакцинации пневмоваксом-23, был снижен при приеме Актемры и метотрексата по сравнению с контрольной группой, принимающей только метотрексат. Доля пациентов с увеличением титра антител против столбнячного анатоксина в обеих группах составила около 40%, что ниже доли респондеров после вакцинации, обнаруженных у здоровых вакцинированных людей. Следовательно, вакцинация против пневмококков и столбнячных антигенов должна проводиться до начала терапии Актемрой.
Рекомендуется, чтобы все пациенты, особенно педиатрические или пожилые, были ознакомлены с последними рекомендациями по вакцинам, если это возможно, до начала терапии Актемра. Интервал между прививками живыми вакцинами и началом терапии Актемрой должен соответствовать действующим рекомендациям по вакцинации иммунодепрессантов.
Влияние на серологическую диагностику инфекций
Влияние на серологический диагноз специфических инфекций при лечении Актемрой не может быть исключено, поскольку соответствующие тесты не проводились.
Изменения в крови
Случаи снижения количества нейтрофилов и тромбоцитов наблюдались при приеме Актемры (см. «Нежелательные эффекты»).
Терапию следует начинать с осторожностью у пациентов с низким количеством нейтрофилов или тромбоцитов (т. Е. Абсолютное количество нейтрофилов менее 2 × 10 9 / л или количество тромбоцитов менее 100 × 10 9 / л).
Рекомендации по корректировке дозы у пациентов со сниженным количеством нейтрофилов или тромбоцитов можно найти в главе «Дозировка / применение, специальные инструкции по дозировке».
Злокачественные заболевания
Риск развития злокачественной опухоли повышен у пациентов с ревматоидным артритом. Клинических данных недостаточно для оценки возможной заболеваемости злокачественными новообразованиями после применения Актемры, хотя имеющиеся данные не указывают на повышенный риск возникновения злокачественных новообразований. Результаты исследований по долгосрочной безопасности еще не доступны.
Сердечно-сосудистые риски
Пациенты с ревматоидным артритом имеют повышенный риск сердечно-сосудистых заболеваний. Поэтому следует тщательно контролировать пациентов с такими факторами риска, как артериальная гипертензия, дислипидемия и сахарный диабет (ЭКГ, измерение артериального давления).
Активация системы комплемента
Активация системы комплемента не может быть исключена во время лечения Актемрой. Доклинические и клинические данные на сегодняшний день не предоставляют никакой соответствующей информации.
Липидные параметры
Наблюдалось увеличение показателей липидов, таких как общий холестерин, тригицериды и / или липопротеины низкой плотности (ЛПНП) (см. «Нежелательные эффекты»).
Параметры липидов следует определять у пациентов, получавших Актемру через 4-8 недель после начала терапии Актемрой. Пациентов следует лечить в соответствии с местными клиническими рекомендациями по лечению гиперлипидемии.
Демиелинизирующие заболевания
Врач должен искать симптомы, которые могут указывать на новое демиелинизирующее заболевание ЦНС. Потенциал демиелинизации центральной нервной системы с помощью тоцилизумаба в настоящее время неизвестен.
Синдром активации макрофагов (MAS)
MAS является серьезным, опасным для жизни заболеванием, которое может развиться у пациентов с sJIA. Актемра не была изучена в клинических испытаниях у пациентов во время эпизода MAS.
Подкожное применение у детей с pJIA
В исследовательском исследовании фазы 1b у 52 детей с pJIA нейтропения чаще регистрировалась при подкожном применении Актемры и были обнаружены нейтрализующие антитела, чем в исследовании фазы 3 с внутривенным использованием Актемры у детей с pJIA.
взаимодействия
Фармакокинетические взаимодействия
Одновременный прием других противовоспалительных препаратов не влияет на фармакокинетику тоцилизумаба у пациентов с РА (MTX, хлорохин и его производные (противомалярийные препараты), иммунодепрессанты (азатиоприн, лефлуномид), кортикостероиды (преднизон и производные), фолиевая кислота и ее производные, нестероидные воспаления, нестероидные воспаления (Диклофенак, Ибупрофен, Напроксен, Мелоксикам), ингибиторы ЦОГ-2 (Целекоксиб)), анальгетики (Парацетамол, Трамадол, Кодеин и его производные). Никакого влияния кумулятивной дозы кортикостероида на воздействие Актемры не наблюдалось у пациентов с РЗА. Совместное введение одной дозы Актемры 10 мг / кг с МТХ 10-25 мг один раз в неделю не оказывало клинически значимого эффекта на воздействие МТХ.
Исследования in vitro
Исследования in vitro на культивируемых гепатоцитах человека показали, что IL-6 снижает экспрессию ферментов CYP1A2, CYP2C9, CYP2C19 и CYP3A4. Тоцилизумаб нормализует экспрессию этих ферментов.
Ферментные ингибиторы
Экспрессия печеночных ферментов CYP450 подавляется цитокинами, такими как IL - 6, которые стимулируют хроническое воспаление. Следовательно, экспрессия CYP450 может измениться, когда ингибирование цитокинов инициируется тоцилизумабом.
Уровни симвастатина, метаболизируемого через CYP3A4, снижались на 57% через неделю после однократного приема тоцилизумаба. Таким образом, пациенты, принимающие лекарства, чья доза подбирается индивидуально и которые метаболизируются с помощью CYP450 3A4, 1A2 или 2C9 (например, аторвастатин, блокаторы кальциевых каналов, теофиллин, варфарин, фенитоин, циклоспорин или бензодиазепины), должны контролироваться в начале и в конце терапии тоцилизумабом. и доза этих веществ может быть скорректирована при необходимости. Учитывая длительный период полувыведения, эффекты тоцилизумаба на активность ферментов CYP450 могут сохраняться в течение нескольких недель после прекращения лечения.
Другие взаимодействия
Актемра не изучалась в сочетании с другими генно-инженерными препаратами, такими как ингибиторы фактора некроза опухоли (ФНО).
Беременность / кормление грудью
беременность
Данных об использовании Актемры у беременных недостаточно.
Исследование на обезьянах не выявило признаков уродства, но показало большее количество самопроизвольных абортов / эмбрионально-эмбриональных смертей в высоких дозах. Потенциальный риск для человека неизвестен.
Актемру не следует использовать во время беременности, если только врач, проводящий лечение, не считает это необходимым.
лактация
Выделение суррогатных антител к тоцилизумабу в грудном молоке было продемонстрировано на мышах (см. «Доклинические данные»). Не известно ли Actemra из организма в материнском молоке, поэтому грудное вскармливание следует прекратить, если использование препарата считается необходимым.
Влияние на способность управлять автомобилем и использовать машины
Не было проведено никаких исследований влияния на способность управлять автомобилем и использовать машины. Тем не менее, нет никаких доказательств того, что лечение Актемрой влияет на вашу способность управлять автомобилем или пользоваться машиной.
Неблагоприятные эффекты
Профиль безопасности в этом разделе - от 4510 пациентов, которых лечили тоцилизумабом в клинических испытаниях; большинство из этих пациентов участвовали в исследованиях РА (n = 4009), тогда как остальные данные были получены в исследованиях pJIA (n = 240), sJIA (n = 112) и RZA (n = 149). Профиль безопасности тоцилизумаба остается схожим и недифференцированным по всем этим показаниям.
Побочные эффекты препарата перечислены в соответствии с их клинической значимостью для пациента и отсортированы в соответствии с классами органов системы MeDRA. Частотная категория для каждого нежелательного эффекта основана на следующем соглашении: очень распространено (≥1 / 10); общий (≥1 / 100 до <1/10); редко (≥1 / 1000 до <1/100); редко (≥1 / 10000 до <1/1000); очень редко (<1/10000); неизвестно (частота не может быть определена из постмаркетингового опыта).
Побочные эффекты, клинические исследования и постмаркетинговый опыт
Расстройства иммунной системы
Общие: реакции гиперчувствительности.
Нечасто: анафилаксия (иногда со смертельным исходом *) (см. «Противопоказания» и «Предупреждения и меры предосторожности»).
* Случаи, о которых сообщалось после запуска
Инфекции и заражения
Очень часто: инфекции верхних дыхательных путей (12,4%).
Общие: оральный простой герпес, опоясывающий лишай.
Сообщалось об отдельных случаях оппортунистических инфекций (в том числе серьезных и в некоторых случаях со смертельным исходом).
Расстройства крови и лимфатической системы
Общие: лейкопения, нейтропения, гипофибриногенемия (наблюдается после продажи).
Нечасто: тромбоцитопения.
Эндокринные расстройства
Нечасто: гипотиреоз.
Нарушения обмена веществ и питания
Общие: гиперхолестеринемия.
Нечасто: гипертриглицеридемия.
Расстройства нервной системы
Общие: головная боль, головокружение.
Глазные болезни
Распространенный: конъюнктивит.
Сосудистые заболевания
Общее: гипертония.
Респираторные, грудной и средостения расстройства
Общие: кашель, одышка.
Частота неизвестна: постмаркетинговые отчеты об интерстициальных заболеваниях легких (включая пневмонит и легочный фиброз), некоторые из которых закончились смертельным исходом.
Желудочно-кишечные расстройства
Общие: стоматит, гастрит, боли в животе.
Нечасто: дивертикулит, желудочно-кишечная перфорация, язва желудочков.
Заболевания печени и желчевыводящих путей
Общее: трансаминазы повышены.
Редко: лекарственное поражение печени, гепатит, желтуха.
Очень редко: печеночная недостаточность.
Нечасто: общий билирубин повышен.
Заболевания кожи и подкожной клетчатки
Общие: целлюлит, сыпь, зуд, крапивница.
Редкий: синдром Стивенса-Джонсона (SJS) (выявлен после запуска).
Почечные и мочевые расстройства
Нечасто: нефролитиаз.
Общие расстройства и условия администрации сайта
Очень часто: реакция в месте инъекции (28,8%).
Общие: периферические отеки.
исследования
Общее: увеличение веса.
Описание выбранных побочных реакций лекарств из клинических испытаний:
Ревматоидный артрит
Пациенты, получавшие внутривенную актемру:
Из 4009 пациентов с РА в клинических испытаниях 3577 проходили лечение в течение не менее 6 месяцев, 3296 - не менее 1 года, 2806 - не менее 2 лет и 1222 - 3 года.
В исследовании WA25204 у 5,3% и 2,2% из 1538 пациентов с РА от средней до тяжелой степени, получавших Актемру, наблюдалось увеличение значений ALT и AST до> 3x ULN. О серьезном случае лекарственного гепатита с гипербилирубинемией сообщалось при лечении Актемрой (см. «Предупреждения и меры предосторожности»).
Пациенты, получавшие подкожную Актемру:
Безопасность Актемры подкожно у пациентов с РА была исследована в исследовании SC-I (WA22762). В этом исследовании оценивалась эффективность и безопасность 162 мг однократно в неделю тоцилизумаба по сравнению с 8 мг / кг внутривенно у 1262 взрослых пациентов с РА. Все пациенты в исследовании получали базовую терапию одним или несколькими небиологическими DMARD. Безопасность и иммуногенность, наблюдаемые при приеме подкожного тоцилизумаба, соответствовали известному профилю безопасности внутривенного тоцилизумаба. Новых или неожиданных побочных реакций не наблюдалось. В группах, получавших тоцилизумаб, которым вводили подкожно, наблюдалась более высокая частота реакций в месте инъекции, чем при подкожных инъекциях плацебо в группах, получавших внутривенно.
Наиболее частыми побочными реакциями (≥5% пациентов, получавших монотерапию или в сочетании с обычными DMARD) были инфекции верхних дыхательных путей, ринофарингит, головная боль, гипертония и повышенные уровни аланинаминотрансферазы (ALT).
иммуногенность
iv Применение: антитела против тоцилизумаба наблюдались у 1,6%, нейтрализующие антитела у 1,1%, последние не влияли на эффект.
В общей сложности 1454 пациента, подвергшихся воздействию sc тоцилизумаба, были протестированы на антитела против тоцилизумаба. Тринадцать пациентов (0,9%) развили положительные антитела против тоцилизумаба; Из них у 12 пациентов (0,8%) развились нейтрализующие антитела против тоцилизумаба. Пять пациентов (0,3%) дали положительный результат на антитела изотипа IgE.
Не было никакой корреляции между развитием антител и клиническим ответом или неблагоприятными событиями.
Реакции в месте инъекции
В течение шести месяцев контролируемой фазы исследования SC-I частота реакций в месте инъекции составляла 10,1% (64/631) при еженедельных подкожных инъекциях Актемры и 2,4% (15/631) при еженедельных подкожных инъекциях плацебо ( ИК группа). Эти реакции в месте инъекции (включая эритему, зуд, боль и гематому) были легкой или средней степени тяжести. Большинство реакций заживали без лечения и не требовали прерывания лечения.
Ранний ревматоидный артрит
В исследовании VI (WA19926) было обследовано 1162 пациента с ранним РА средней или тяжелой степени тяжести, которые ранее не получали MTX или биологический агент. Профиль безопасности в группах лечения тоцилизумабом в целом соответствовал известному профилю безопасности тоцилизумаба (см. Также «Нежелательные эффекты»).
В исследовании VI уменьшение нейтрофилов и тромбоцитов, а также увеличение показателей липидов и увеличение липидов были более частыми у взрослых пациентов с активным RA средней и тяжелой степени, которые ранее не получали лечение MTX и которые имели активную RA средней и тяжелой степени тяжести на ранних стадиях (средняя продолжительность заболевания ≤6 месяцев) в сочетании с MTX, а также в виде монотерапии Актемрой. По сравнению с одним только MTX, увеличение ALT, AST и билирубина также чаще встречалось при комбинации Актемра плюс MTX, чем при использовании одного MTX.
Гигантоклеточный артериит
Безопасность тоцилизумаба, вводимого подкожно, была исследована в исследовании III фазы (WA28119) у 251 пациента с RZA. Общая продолжительность участия в коллективе " All Exposure" под лечением тоцилизумабом в течение 12-месячного двойного слепого плацебо-контролируемого периода исследования составила в общей сложности 138,5 пациентов. Общий профиль безопасности, наблюдаемый в группах, получавших тоцилизумаб, коррелировал с известным профилем безопасности тоцилизумаба (Таблица 4, см. Клиническую эффективность).
инфекции
Частота инфекций / серьезных случаев инфекции была в еженедельной группе, получавшей тоцилизумаб (200,2 / 9,7 случая на 100 пациенто-лет), в сравнении с группой, получавшей плацебо, плюс 26-недельная преднизоновая доза (156,0 / 4). (2 случая на 100 пациентов) и в группе, получавшей плацебо плюс 52 недели преднизона с повышением дозы (210,2 / 12,5 событий на 100 пациентов).
Профиль побочных эффектов, сопоставимый с тем, который наблюдался в других исследованиях с Актемрой, наблюдался у пациентов с RZA.
Полиартикулярный ювенильный идиопатический артрит
Профиль безопасности тоцилизумаба был изучен у 240 детей с pJIA. В исследовании WA19977 188 пациентов (в возрасте от 2 до 17 лет) получали внутривенно тоцилизумаб, а в исследовании WA28117 52 пациента (в возрасте от 1 до 17 лет) получали подкожно тоцилизумаб. Общее воздействие в популяции всех пациентов, подвергшихся воздействию тоцилизумаба с pJIA, составило 184,4 года пациентов для внутривенного введения тоцилизумаба и 50,4 года пациентов для sc тоцилизумаба. Профиль безопасности, наблюдаемый у пациентов с pJIA, в целом соответствовал известному профилю безопасности тоцилизумаба, за исключением реакций в месте инъекции (см. Таблицу 1), однако количественно больше случаев нейтропении и нейтрализующих антител наблюдалось при подкожном введении Актемры (см. также ниже). У пациентов с pJIA наблюдалась более высокая частота реакций в месте инъекции после подкожных инъекций тоцилизумаба, чем у взрослых пациентов с РА (см. «Нежелательные эффекты»).
Аутоиммунные заболевания
В клинических исследованиях наблюдались отдельные случаи миастении, системного склероза и увеита. Пациенты с pJIA обычно имеют более высокий риск аутоиммунных заболеваний. Причинная связь с тоцилизумабом неясна.
инфекции
Наиболее частыми событиями, наблюдаемыми в pJIA, были инфекции. Уровень инфицирования в популяции всех пациентов, подвергшихся внутривенному введению тоцилизумаба с pJIA, составил 163,7 на 100 пациенто-лет. Наиболее частыми проявлениями были назофарингит и инфекции верхних дыхательных путей.
При 12,2 на 100 пациенто-лет частота серьезных инфекций была численно выше у пациентов в возрасте до 30 кг и 10 мг / кг тоцилизумаба, чем у пациентов в возрасте до 30 кг и 8 мг / кг тоцилизумаба (3,7 на 100 пациентов) и у пациентов> 30 кг и 8 мг / кг тоцилизумаба (4,0 на 100 пациенто-лет). Кроме того, доля пациентов с инфекциями, которые привели к прерыванию лечения, была численно выше у пациентов с тоцилизумабом <30 кг и 10 мг / кг (21,4%), чем у пациентов с тоцилизумабом> 30 кг и 8 мг / кг (7,6%). ). Уровень инфицирования у пациентов с pJIA, получавших sc тоцилизумаб, был сопоставим с таковым у пациентов с pJIA, получавших внутривенное введение тоцилизумаба.
Инфузионная реакция
У пациентов с pJIA реакции, связанные с инфузией, определяются как все события, которые происходят во время или в течение 24 часов после инфузии тоцилизумаба внутривенно. В популяции всех пациентов, подвергшихся воздействию тоцилизумаба, 11 пациентов (5,9%) испытывали инфузионные реакции во время инфузии, а 38 пациентов (20,2%) испытывали событие в течение 24 часов после инфузии. Наиболее распространенными событиями, которые произошли во время инфузии, были головная боль, тошнота и гипотония; Наиболее частыми событиями, происходящими в течение 24 часов после инфузии, были головокружение и гипотония. В целом, тип побочных реакций лекарственного средства, наблюдаемых во время или в течение 24 часов после вливания, был сопоставим с таковым у пациентов с RA и sJIA.
иммуногенность
В трех исследованиях на пациентах с pJIA в общей сложности шесть пациентов (0,5% [1/188] в исследовании iv WA19977 и 9,6% [5/52] в исследованиях sc WA28117 и WA29231) разработали положительные нейтрализующие антитела против тоцилизумаба ; ни у одного из этих пациентов не было серьезной или клинически значимой реакции гиперчувствительности. Три из этих шести пациентов впоследствии выбыли из исследования. Не было никакой корреляции между развитием антител и клиническим ответом или неблагоприятными событиями.
Реакции в месте инъекции (ISR)
В общей сложности у 28,8% (15/52) пациентов с pJIA развилась ISR после введения подкожного тоцилизумаба. Этот ISR встречался у 44% пациентов> 30 кг, по сравнению с 14,8% пациентов до 30 кг. Наиболее распространенными ISR были эритема, отек, гематома, боль и зуд в месте инъекции. Все зарегистрированные ISR были несерьезными событиями 1 степени, и ни один из ISR не требовал прекращения лечения или прерывания дозы.
Лабораторные показатели в популяции pJIA, подвергшейся воздействию тоцилизумаба
В рутинных лабораторных исследованиях популяции всех пациентов, подвергшихся воздействию тоцилизумаба, снижение количества нейтрофилов до менее чем 1 × 10 9 / л было зафиксировано у 3,7% пациентов с тоцилизумабом и у 15,4% пациентов с тоцилизумабом .
Профиль побочных эффектов, аналогичный лабораторным значениям, наблюдался у пациентов с pJIA, как и в других исследованиях с Актемрой.
Системный ювенильный идиопатический артрит
Профиль безопасности тоцилизумаба при sJIA был изучен у 163 детей. В исследовании WA18221 (12-недельное долгосрочное последующее исследование) 112 пациентов (от 2 до 17 лет) лечились внутривенно тоцилизумабом, а в исследовании WA28118 (52-недельное исследование) 51 пациент (от 1 до 17 лет) лечился подкожным тоцилизумабом.
Никаких новых или неожиданных нежелательных явлений не наблюдалось у одиннадцати педиатрических пациентов с sJIA в возрасте до 2 лет во время фазы I исследования (NP25737). Однако частота серьезной гиперчувствительности 3/11 (27%), включая анафилаксию, была выше у этих пациентов, чем у пациентов с sJIA в возрасте от 2 лет и старше.
В целом, побочные реакции на лекарства у пациентов с sJIA были аналогичны тем, которые наблюдались у пациентов с РА (см. «Нежелательные эффекты» выше).
инфекции
В 12-недельном контролируемом исследовании (исследование WA18221) частота всех инфекций составила 344,7 на 100 пациентов в группе, получавшей внутривенно тоцилизумаб, и 287,0 на 100 пациентов в группе плацебо.
В 12-недельном контролируемом исследовании (исследование WA18221) частота серьезных инфекций в группе, получавшей внутривенно тоцилизумаб, составила 11,5 на 100 пациенто-лет.
Уровень инфицирования у пациентов с sJIA, получавших sc тоцилизумаб, был сопоставим с таковым у пациентов с sJIA, получавших внутривенное введение тоцилизумаба.
Инфузионная реакция
У пациентов с sJIA реакции, связанные с инфузией, определяются как все события, которые происходят во время инфузии тоцилизумаба или через 24 часа после этого. В 12-недельном контролируемом исследовании (исследование WA18221) четыре процента (4,0%) пациентов в группе тоцилизумаба испытывали аналогичные события во время инфузии, при этом одно событие (ангионевротический отек) считалось серьезным и опасным для жизни, так что исследование было прервано для соответствующего пациента.
Событие произошло в течение 24 часов после инфузии у 16% пациентов в группе внутривенного введения тоцилизумаба и у 5,4% пациентов в группе плацебо. События в группе тоцилизумаба включали сыпь, крапивницу, диарею, эпигастральный дискомфорт, артралгию и головную боль. Одно из этих событий (крапивница) было классифицировано как серьезное.
Клинически значимые реакции гиперчувствительности, связанные с в / в тоцилизумабом, требующие прекращения лечения, были зарегистрированы у 1 из 112 (менее 1%) пациентов, получавших в / в тоцилизумаб, в контролируемом и открытом клиническом исследовании.
Реакции в месте инъекции
В исследовании SC WA28118 у 41,2% (21/51) пациентов с sJIA развилась ISR на подкожном тоцилизумабе. Наиболее распространенными ISR были эритема, зуд, боль и опухоль в месте инъекции. Большинство ISR были событиями степени 1, ни одно из зарегистрированных ISR не было серьезным, и ни один из ISR не требовал прекращения лечения или прерывания дозы у каждого пациента.
Лабораторные показатели в популяции sJIA, подвергшейся воздействию тоцилизумаба
нейтрофилы:
В рамках рутинного мониторинга лабораторных показателей в 12-недельном контролируемом исследовании IV (исследование WA18221) нейтрофилы были снижены до менее чем 1 × 10 у 7% пациентов в группе, получавшей тоцилизумаб, и ни у одного из пациентов в группе плацебо 9 / л вкл.
В открытом исследовании расширения (WA18221) 15% пациентов в группе, получавшей внутривенно тоцилизумаб, испытывали снижение нейтрофилов до уровня менее 1 × 10 9 / л.
В 52-недельном открытом исследовании (исследование WA28118) нейтрофилы были снижены до менее чем 1 × 10 9 / л у 23,5% пациентов, получавших sc тоцилизумаб .
тромбоциты:
В рамках рутинного мониторинга лабораторных показателей в 12-недельном контролируемом исследовании (исследование WA18221) sJIA испытал снижение уровня тромбоцитов до ≤ 100 × у 3% пациентов в группе плацебо и у 1% пациентов в группе, получавших внутривенное введение тоцилизумаба 10 3 / мкл. В открытом исследовании расширения (WA18221) у 3% пациентов в группе, получавшей внутривенно тоцилизумаб, было снижение уровня тромбоцитов до менее чем 100 × 10 3 / мкл без каких-либо кровотечений. В 52-недельном открытом исследовании (исследование WA28118) количество тромбоцитов снизилось до менее чем 100 × 10 3 / мкл у 2% пациентов, получавших sc тоцилизумаб .
Ферменты печени:
В рамках рутинного мониторинга лабораторных показателей в 12-недельном контролируемом исследовании (исследование WA18221) увеличение ALT и AST наблюдалось у 5% и 3% пациентов в группе, получавших внутривенное введение тоцилизумаба, и у 0% пациентов в группе плацебо до ≥3 х ONG.
В открытом расширенном исследовании (WA18221) ALT и AST увеличились до ≥3 x ONG у 12% и 4,0% пациентов в группе, получавшей тоцилизумаб, соответственно.
В 52-недельном открытом исследовании (исследование WA28118) ALT и AST увеличились до ≥3 x ONG у 9,8% и 4,0% пациентов, получавших sc тоцилизумаб, соответственно.
Липидные параметры:
С помощью sJIA, как часть обычного мониторинга лабораторных показателей в 12-недельном контролируемом исследовании (исследование WA18221), уровень холестерина ЛПНП увеличился до ≥130 мг / дл или общего уровня холестерина у 13,4% и 33,3% пациентов. ≥200 мг / дл. В открытом исследовании расширения (WA18221) значение холестерина ЛПНП увеличилось до ≥130 мг / дл, а значение общего холестерина до ≥200 мг / дл у 13,2% и 27,7% пациентов. В 52-недельном открытом исследовании (исследование WA28118) значение холестерина ЛПНП увеличилось до ≥130 мг / дл, а значение общего холестерина до ≥200 мг / дл у 23,4% и 35,4% пациентов.
иммуногенность
В исследовании NP25737 у 3 из 11 пациентов развились вызванные лечением антитела против тоцилизумаба. Из этих 3 пациентов у 2 была выраженная реакция гиперчувствительности, у 1 - тромбоцитопения, и все они привели к прекращению лечения. Из-за небольшого количества случаев, небольшого количества событий и из-за разрушительных факторов не может быть сделано никаких выводов.
Пациенты с CRS
Безопасность тоцилизумаба при CRS была исследована в ретроспективном анализе данных клинических исследований, в которых 51 пациент с тоцилизумабом 8 мг / кг (12 мг / кг у пациентов ниже 30 кг) с добавлением или без добавления высоких доз кортикостероидов из-за тяжелого или опасного для жизни CAR -T-клеточно-индуцированный CRS лечили. В среднем вводили 1 дозу тоцилизумаба (диапазон: от 1 до 4 доз).
передозировка
Данные о передозировке с помощью Актемры ограничены. Сообщалось об одном случае случайной передозировки, при котором пациент с множественной миеломой получал однократную внутривенную дозу 40 мг / кг массы тела. Побочных эффектов не наблюдалось.
Признаки и симптомы
Никаких серьезных побочных эффектов не наблюдалось у здоровых субъектов, которые получали однократную внутривенную дозу до 28 мг / кг массы тела, и была обнаружена ограниченная по дозе нейтропения.
Свойства / эффекты
Код УВД
L04AC07
Механизм действия
Тоцилизумаб представляет собой рекомбинантное гуманизированное моноклональное антитело IgG1 против человеческого рецептора интерлейкина-6.
Тоцилизумаб связывается как с растворимыми, так и с мембранно-связанными рецепторами IL-6 (sIL-6R и mIL-6R) и ингибирует передачу сигнала. IL-6 представляет собой плейотропный провоспалительный цитокин, который продуцируется различными клетками, включая Т- и В-клетки, лимфоциты, моноциты и фибробласты. IL-6 участвует в различных физиологических процессах, таких как активация Т-клеток, запуск секреции Ig В-клетками, запуск синтеза белков острой фазы печени и стимуляция кроветворения. IL-6 играет роль в патогенезе таких заболеваний, как воспалительные реакции, остеопороз и неоплазия.
фармакодинамика
Лечение Актемрой у пациентов с РА приводит к быстрому снижению С-реактивного белка, снижению уровня эритроцитов, сывороточного амилоида А, фибриногена, белков острой фазы и снижению числа тромбоцитов. Наблюдается увеличение гемоглобина. Ингибирование IL-6 увеличивает доступность железа из-за снижения в острой фазе белка гепсидина. Снижение уровня СРБ до нормы наблюдалось у пациентов, получавших Актемру, уже на второй неделе, и это значение оставалось постоянным на протяжении всего периода лечения.
Нейтропения с надиром наблюдается в дни 3-6 во время лечения тоцилизумабом (см. «Предупреждения и меры предосторожности»).
Клиническая эффективность
Ревматоидный артрит
Пациентам на Актемре вводят внутривенно
В двух исследованиях по определению дозы Актемра изучалась в комбинации с метотрексатом или в качестве монотерапии в дозах 2, 4 и 8 мг / кг каждые 4 недели. В 5 контролируемых двойных слепых исследованиях III фазы - длительность от 3 до 6 месяцев - Актемру обследовали у пациентов с умеренным и тяжелым ревматоидным артритом (средний балл DAS28 от 6,5 до 7), которые были невосприимчивы к предварительной терапии со средним показателем 1-3 DMARD. Средняя продолжительность болезни должна была составлять не менее 6 месяцев, обычно она составляла в среднем 7-9 лет. Все пациенты имели метотрексат в дозе от 10 до 25 мг в исследованиях WA17822 и WA17823 или DMARD в исследовании WA18063 в качестве предшествующей терапии. В исследование WA18062 были включены пациенты после дополнительной предварительной обработки ингибиторами TNF-альфа.
ACR20 (улучшение на 20% в соответствии с критериями Американского колледжа ревматологии) было зарегистрировано в качестве основной конечной точки. Вторичными конечными точками были ACR50, ACR70 и ACRn, оценка активности заболевания DAS28, а также критерии EULAR и, кроме того, качество жизни в отдельных исследованиях. В общей сложности 1406 пациентов получили лечение Актемрой, 1010 - базовой терапией DMARD.
Результаты этих исследований за 24 недели демонстрируют эффективность Актемры как для 4, так и для 8 мг / кг в первичной конечной точке и для всех других используемых шкал, с лучшими результатами для тоцилизумаба 8 мг / кг.
Другое исследование WA17824 сравнивало эффекты тоцилизумаба с метотрексатом. Были включены пациенты с умеренным или тяжелым ревматоидным артритом, которые не получали терапию метотрексатом в течение последних 6 месяцев и у которых терапия метотрексатом не прекращалась из-за непереносимости или отсутствия ответа. Средняя продолжительность болезни составила 3 года. Медиана предварительной обработки составила 1,0 (0-7). Исследование имело период запуска 8 недель (спасение было разрешено здесь), а затем было рандомизировано либо для метотрексата, начиная с 7,5 мг (увеличение до 20 мг), либо для Актемры 8 мг / кг. В первичной конечной точке ACR20 через 24 недели Актемра 8 мг / кг была на 70% выше, чем метотрексат на 52,5%.
Это исследование показало большие различия в ответе ACR20 между группами пациентов на метотрексат и тоцилизумаб по регионам и подгруппам: Северная Америка 38% против 48%, Европа 58% против У 80% пациентов с отрицательным ревматоидным фактором сравнение с метотрексатом лучше, чем у пациентов с положительным ревматоидным фактором. Данные более 24 недель еще не доступны.
Пациенты проходили лечение в двух открытых долгосрочных исследованиях. Пока есть опыт работы более 2 лет. Это показывает, что эффект сохраняется.
Имеются двухлетние данные исследования WA17823 о влиянии радиологической прогрессии. Эти данные показывают, что тоцилизумаб в сочетании с метотрексатом значительно снижает радиологическое прогрессирование по сравнению с плацебо и метотрексатом (измеренным с использованием модифицированного по Genant Sharp Score). 83% пациентов не показали прогрессирования структурных повреждений при лечении тоцилизумабом / метотрексатом по сравнению с 67% пациентов, получавших плацебо / MTX.
Ранний RA без предварительной обработки MTX (WA19926)
В исследовании VI, двухлетнем исследовании, было обследовано 1162 взрослых пациента без предварительной терапии MTX с активным RA средней и тяжелой степени тяжести на ранних стадиях (средняя продолжительность болезни ≤6 месяцев). В этом исследовании эффективность комбинированной терапии внутривенным введением тоцилизумаба 4 или 8 мг / кг каждые 4 недели и MTX, монотерапии с внутривенным введением тоцилизумаба 8 мг / кг и монотерапии MTX в уменьшении признаков и симптомов и скорости прогрессирования Повреждения суставов были исследованы в течение 104 недель. Первичной конечной точкой была доля пациентов с ремиссией DAS28 (DAS28 <2,6) на 24 неделе. В группе тоцилизумаба 8 мг / кг + MTX, а также в группе монотерапии тоцилизумабом, значительно больше пациентов достигли первичной конечной точки, чем в группе монотерапии MTX (подробности см. В таблице 1 ниже для 3 из 4 групп лечения). в этом исследовании). В группе, получавшей тоцилизумаб 8 мг / кг + МТХ, также были достигнуты статистически значимые результаты в отношении наиболее важных вторичных конечных точек.
Таблица 1: Результаты эффективности исследования VI (WA19926) у пациентов с ранним РА без предварительной обработки MTX
TCZ 8 мг / кг + MTX | TCZ 8 мг / кг + плацебо | Плацебо + MTX | |||
Основная конечная точка | |||||
DAS28 ремиссия | |||||
24 неделя | n (%) | 130 (44,8) *** | 113 (38,7) *** | 43 (15,0) | |
Ключевые вторичные конечные точки | |||||
DAS 28 ремиссия | |||||
52 неделя | n (%) | 142 (49,0) *** | 115 (39,4) | 56 (19,5) | |
ACR | |||||
24 неделя | ACR20, n (%) | 216 (74,5) * | 205 (70,2) | 187 (65,2) | |
| ACR50, n (%) | 165 (56,9) ** | 139 (47,6) | 124 (43,2) | |
| ACR70, n (%) | 112 (38,6) ** | 88 (30,1) | 73 (25,4) | |
52 неделя | ACR20, n (%) | 195 (67,2) * | 184 (63,0) | 164 (57,1) | |
| ACR50, n (%) | 162 (55,9) ** | 144 (49,3) | 117 (40,8) | |
| ACR70, n (%) | 125 (43,1) ** | 105 (36,0) | 83 (28,9) | |
HAQ-DI (скорректированное среднее изменение по сравнению с исходным уровнем) | |||||
52 неделя |
| -0,81 * | -0,67 | -0,64 | |
Рентгенографические конечные точки (среднее изменение от базовой линии) | |||||
52 неделя |
| 0,08 *** | 0,26 | 1,14 | |
Оценка эрозии |
| 0,05 ** | 0,15 | 0,63 | |
JSN |
| 0.03 | 0,11 | 0,51 | |
Рентгенографическая непрогрессия n (%) |
| 226 (83) ‡ | 226 (82) ‡ | 194 (73) | |
Все сравнения эффективности против плацебо + MTX. *** р≤0,0001; ** р <0,001; * р <0,05;
‡ р-значение <0,05 против Плацебо + MTX.
Монотерапия: Актемра против адалимумаба
В рандомизированном двойном слепом исследовании у 326 пациентов с РА, которые либо не переносили MTX, либо не считали, что они могут продолжать лечение MTX, можно продемонстрировать статистически значимый эффект лечения Актемрой (TCZ) 8 мг в отношении контроля активности заболевания. / кг внутривенно каждые 4 недели в сравнении с адалимумабом (ADA) 40 мг подкожно каждые 2 недели (разница по первичной конечной точке DAS28 от базовой линии на 24 неделе: ADA -1,8, TCZ -3,3 95% CI -1,5 (-1,8) , -1,1), р <0,0001).
Пациенты, получавшие Актемру подкожно
Эффективность Актемры, вводимой подкожно, оценивалась в двойном слепом, контролируемом, многоцентровом исследовании у пациентов с активным РА. В исследование (SC-I) были включены пациенты старше 18 лет с активным ревматоидным артритом, диагностированным в соответствии с критериями ACR, и по меньшей мере 4 болезненных и 4 опухших сустава на исходном уровне. Все пациенты получали базовую терапию одним или несколькими небиологическими DMARD.
СК-я учусь
В исследовании SC-I были оценены пациенты с ревматоидным артритом средней или высокой степени тяжести, которые недостаточно ответили на ревматологическую терапию, включая один или несколько DMARD. Около 20% ответили неадекватно по крайней мере на один ингибитор ФНО-альфа. В исследовании SC-I 1262 пациентам было случайным образом назначено лечение 1: 1 162 мг тоцилизумаба один раз в неделю подкожно или 8 мг / кг тоцилизумаба каждые четыре недели в / в в сочетании с одним или несколькими небиологическими DMARD. Первичной конечной точкой исследования была разница в доле пациентов, которые достигли ответа ACR20 на 24 неделе. Результаты исследования SC-I показаны в таблице 2.
Таблица 2: Клинический ответ на 24 неделе в подкожном исследовании (процент пациентов)
SC-I | ||
TCZ 162 мг один раз в неделю подкожно | TCZ 8 мг / кг внутривенно | |
ACR20 | ||
24 неделя | 69,4% | 73,4% |
Взвешенная разница (95% ДИ) | -4,0 (-9,2, 1,2) | |
ACR50 | ||
24 неделя | 47,0% | 48,6% |
Взвешенная разница (95% ДИ) | -1,8 (-7,5, 4,0) | |
ACR70 | ||
24 неделя | 24,0% | 27,9% |
Взвешенная разница (95% ДИ) | -3,8 (-9,0, 1,3) | |
Изменение в DAS28 [скорректированное среднее] | ||
24 неделя | 3,5 | 3,5 |
Скорректированная средняя разница (95% ДИ) | 0 (-0,2, 0,1) | |
DAS28 <2,6 | ||
24 неделя | 38,4% | 36,9% |
Взвешенная разница (95% ДИ) | 0,9 (-5,0, 6,8) | |
EULAR ответ (%) | ||
Нет ответа | 3,3% | 4,8% |
Умеренный ответ | 41,7% | 42,7% |
Хороший ответ | 55,0% | 52,4% |
TCZ = тоцилизумаб.
а = в соответствии с протоколом населения.
SC-II исследование
Клинический и рентгенологический ответ на Актемру, вводимый подкожно, был исследован в двойном слепом контролируемом многоцентровом исследовании у пациентов с РА в сочетании с метотрексатом. В этом исследовании (SC-II) оценивали пациентов с активным ревматоидным артритом от умеренной до тяжелой степени, которые недостаточно ответили на ревматологическую терапию, включая один или несколько DMARD. Около 20% ответили неадекватно по крайней мере на один ингибитор ФНО. В исследование были включены пациенты старше 18 лет с активным ревматоидным артритом, диагностированным в соответствии с критериями ACR, и по меньшей мере 8 болезненных и 6 опухших суставов в начале исследования. В исследовании SC-II 656 пациентов получили лечение в 2:
В исследовании SC-II ингибирование структурного повреждения суставов оценивали рентгенологически и выражали в виде изменения среднего общего балла по Шарпу (mTSS), модифицированного Ван дер Хейде. На 24-й неделе было показано ингибирование структурного повреждения сустава со значительно меньшим прогрессированием у пациентов, принимавших подкожноцитозумаб, по сравнению с плацебо (mTSS 0,62 против 1,23, р = 0,0149 (van Elteren)).
Результаты исследования SC-II можно найти в таблице 3.
Таблица 3: ответ ACR в исследовании SC-II (процент пациентов в%) на 24 неделе
СК-II б | ||
TCZ SC 162 мг каждые две недели | Плацебо | |
Изменения с самого начала обучения Ван дер Хейде mTSS | 0,62 | 1,23 * |
ACR20 | 61% | 32% ** |
ACR50 | 40% | 12% ** |
ACR70 | 20% | 5% ** |
TCZ = тоцилизумаб.
Средний суммарный резкий балл = mTSS.
* Р <0,05 , Tocilizuma б против Плацебо + DMARD.
** р <0,0001 , тоцилизума b против Плацебо + DMARD.
b Население, предназначенное для лечения.
Средний балл DAS28 на исходном уровне составил 6,7 в подкожной ветви и 6,6 в группе плацебо. На 24 неделе у пациентов в подкожном отделе наблюдалось значительное снижение показателя DAS28 по сравнению с исходным уровнем на 3,1% по сравнению с 1,7 в группе с плацебо. Снижение показателя DAS28 <2,6 наблюдалось у 32% пациентов в подкожной ветви и у 4,0% пациентов в группе плацебо.
Гигантоклеточный артериит (РЗА)
Исследование WA28119 было рандомизированным, многоцентровым, двойным слепым, плацебо-контролируемым, исследование фазы III, чтобы оценить превосходство эффективности и безопасности тоцилизумаба у пациентов с ИППП.
251 пациент с новой или рецидивирующей STA был госпитализирован, и каждый назначен на одну из четырех групп лечения.
Две подкожные (подкожно) дозы тоцилизумаба (162 мг каждую неделю и 162 мг каждые две недели) сравнивали с двумя различными контрольными группами плацебо в соотношении рандомизации 2: 1: 1: 1.
Все пациенты получали базовую глюкокортикоидную терапию (преднизон) до включения в исследование, которая не должна превышать 60 мг / день, когда исследование было включено. Каждая из групп, получавших тоцилизумаб, и одна из групп, принимавших плацебо, следовали 26-недельному режиму преднизолона, в то время как вторая группа плацебо следовала 52-недельному режиму преднизона, который был более активным основанный на стандартной практике.
Было статистически значимое преимущество лечения в пользу тоцилизумаба по сравнению с плацебо с точки зрения достижения устойчивой ремиссии без стероидов на 52 неделе с тоцилизумабом плюс 26-недельный преднизон плюс побег по сравнению с плацебо плюс 26-недельный преднизон Повышение дозы и плацебо плюс 52 недели введения преднизона с определением увеличения дозы.
Таблица 4 ниже показывает процент пациентов, у которых была ремиссия на 52 неделе.
Вторичные конечные точки
Оценка промежутка времени до первого рецидива RZA показала значительно более низкий риск рецидива в еженедельной подкожной группе тоцилизумаба по сравнению с группой, получавшей плацебо плюс 26 недель преднизона с повышением дозы, и группой, получавшей плацебо плюс 52 недели Введение преднизона с повышением дозы.
Средняя кумулятивная доза преднизона на 52 неделе была значительно ниже (p≤0,0003) в обеих группах тоцилизумаба (1862,0 мг в обеих группах), чем в двух группах плацебо (3296,0 мг (элиминация через 26 недель) и 3817,0 мг (сужается через 52 недели).
Таблица 4: Результаты эффективности из исследования WA28119
PBO + 26-недельный преднизон с увеличением дозы | ПБО + 52-недельный преднизон с увеличением дозы | TCZ 162 мг sc qw + 26-недельный преднизон с увеличением дозы | TCZ 162 мг sc q2w + 26-недельный преднизон с увеличением дозы | |
Основная конечная точка | ||||
Стойкая ремиссия (группы TCZ против PBO + 26) | ||||
Респонденты на 52 неделе, n (%) | 7 (14%) | 9 (17,6%) | 56 (56%) | 26 (53,1%) |
Разница акций до коррекции | н.з | н.з | 42% * | 39,06% * |
Наиболее важная вторичная конечная точка | ||||
Стойкая ремиссия (группы TCZ против PBO + 52) | ||||
Респонденты на 52 неделе, n (%) | 7 (14%) | 9 (17,6%) | 56 (56%) | 26 (53,1%) |
Разница акций до коррекции | н.з | н.з | 38,35% * | 35,41% ** |
* р <0,0001
** р <0,005 (Порог значимости для тестов превосходства, связанных с первичной и основной вторичной конечной точкой)
*** Описательное значение р <0,005
¹ Анализ периода (в днях) между клинической ремиссией и первым началом
2 p-значения определяются с использованием анализа Ван Элтерена для непараметрических данных
§ Статистический анализ не проводился.
nz = не применимо
HR = коэффициент опасности; AI = доверительный интервал
TCZ: тоцилизумаб
ПБО: плацебо
qw: недельная дозировка
q2w: дозировка каждые две недели
Полиартикулярный ювенильный идиопатический артрит
Эффективность внутривенной Actemra была оценена в исследовании фазы 3, включая открытую фазу расширения у детей с активным полиартикулярным ювенильным идиопатическим артритом (pJIA), которые неадекватно реагировали или не переносили терапию метотрексатом. За 16-недельной открытой вводной фазой с Актемрой (n = 188) последовала 24-недельная рандомизированная двойная слепая плацебо-контролируемая фаза отмены (ITT, n = 163). Последующая открытая фаза продления длилась более 64 недель. Доза Actemra для пациентов ≥30 кг составляла 8 мг / кг, тогда как для пациентов <30 кг две группы сравнивались с дозами 8 мг / кг или 10 мг / кг. Респонденты после индукции (JIA ACR30) были переведены в плацебо-контролируемую фазу абстиненции и получали либо Актемру в той же дозе, что и во время фазы индукции, или плацебо. Анализ проводился в двух слоях с комедиацией метотрексата или кортикостероидов и без таковой.
Первичной конечной точкой была доля пациентов с вспышкой JIA ACR-30 на 40 неделе по сравнению с 16 неделей. Сорок восемь процентов (48,1%, 39/81) пациентов, получавших плацебо, вспыхнули по сравнению с 25, 6% (21/82) пациентов, получавших Актемру (р = 0,0024).
После первых 16 недель лечения доля пациентов с JIA ACR30, 50, 70 или 90 ответом составила 89,4%, 83,0%, 62,2% и 26,1% соответственно. После плацебо-контролируемой фазы абстиненции (неделя 40) ответы JIA ACR30, 50 и 70 составили 74,4%, 73,2% и 64,6% по сравнению с пациентами, получавшими плацебо (54,3%, 51,9% или 42,0%) (р <0,01).
Во время плацебо-контролируемой фазы (неделя 40) ответы JIA ACR30, 50, 70 и 90 были выше у метотрексат-комедийных пациентов с Актемрой (79,1%, 77,6%, 67,2% и 47,8%) по сравнению с пациентами Актемры, которые не получали метотрексат (53,3%, 53,3%, 53,3% и 33,3% соответственно). Частота ответов также была выше у пациентов без предварительной терапии биологическими препаратами (83,6%, 83,6%, 72,7% и 58,2% по сравнению с 55,6%, 51,9%, 48,1% и 18,5%).
52-недельное открытое исследовательское многоцентровое исследование PK-PD и безопасности (WA28117) было проведено у детей с ПДЖИА в возрасте от 1 до 17 лет. Пациенты получали тоцилизумаб в двух разных дозах в зависимости от массы тела (кг), при этом пациенты весили ≥30 кг (n = 25), 162 мг тоцилизумаба каждые 2 недели (Q2W) и пациенты весили менее 30 кг (n = 27). ) Получали 162 мг тоцилизумаба каждые 3 недели (Q3W). Из этих 52 пациентов 37 (71%) ранее не лечились тоцилизумабом; 15 (29%) получили IV TCZ и переключились на sc TCZ в начале обучения.
Результаты исследовательской эффективности показали, что sc тоцилизумаб улучшал средний показатель активности болезни ювенильного артрита (JADAS) -71 в обеих весовых группах (до 30 кг и ≥ 30 кг) в ходе исследования в обеих весовых группах и у пациентов, которые переключился с внутривенного лечения на подкожное лечение TCZ, поддерживаемое медианой JADAS-71. Тем не менее, при различном воздействии Актемры наблюдался более высокий ответ через 52 недели (неактивное заболевание, клиническая ремиссия) у более мелких пациентов с массой тела <30 кг, чем у детей более старшего возраста с> 30 кг. И наоборот, было больше случаев нейтропении 3 степени у детей <30 кг.
Системный ювенильный идиопатический артрит
В 12-недельном двойном слепом плацебо-контролируемом исследовании лечение проводилось либо с внутривенным введением тоцилизумаба, либо с вливаниями плацебо каждые 2 недели; Пациенты весом <30 кг получали тоцилизумаб 12 мг / кг (n = 38), пациенты весом> 30 кг получали 8 мг / кг (n = 37) и плацебо получали n = 37. Были включены пациенты с персистирующей активностью заболевания (лихорадка, серозит, сыпь, спленомегалия) в течение не менее 6 месяцев с 5 активно пораженными суставами или 2 активно пораженными суставами плюс лихорадка (> 38 ° C). Суставы были оценены независимым слепым экспертом. Доза кортикостероида может быть изменена только в соответствии с правилами, заранее определенными в протоколе исследования.
Первичной конечной точкой была доля пациентов с 30% снижением JIA ACR (JIA-ACR30) через 12 недель и без лихорадки в предыдущие 7 дней. Это было сделано в руки против tocilizumab против 85% против плацебо 24,3% достигнуты. На вторичных конечных точках JIA-ACR50, JIA-ACR70 и JIA-ACR90 это было достигнуто с тоцилизумабом на 85,3%, 70,7% и 37,5%. Уменьшение боли также показало значительный эффект по сравнению с плацебо. Доза кортикостероидов была снижена на 20% у 24% пациентов с тоцилизумабом к 12 неделе.
В начале исследования у 54,7% пациентов наблюдалась высокая температура и 28% сыпь, которая была несколько более выраженной в группе детей весом до 30 кг с 68,4% и 34,2%. 85% пациентов стали лихорадящими без лечения тоцилизумабом. Лимфаденопатия, спленомегалия и гепатомегалия составляли 9,3%, 5,3% и 6,7% в начале исследования и 5,4%, 1,5% и 0% после 12 недель лечения тоцилизумабом. В дополнение к СРБ и СОЭ он также улучшился у пациентов с патологическими исходными значениями значения Hb, количества тромбоцитов и сывороточного амилоида А. Улучшение качества жизни, измеренное по шкале CHAQ-DI, составило 77% с тоцилизумабом и 19% с плацебо.
52-недельное открытое многоцентровое исследование PK / PD и безопасности (WA28118) было проведено у педиатрических пациентов с sJIA в возрасте от 1 до 17 лет, в которых два различных режима доз подкожной терапии в зависимости от массы тела <30 кг и> 30 кг были рассмотрены. Приемлемые пациенты получали дозу TCZ, скорректированную на их массу тела (BW), причем пациенты с весом ≥ 30 кг (n = 26) получали 162 мг TCZ каждую неделю (qw) в течение 52 недель, а пациенты с массой тела менее 30 кг ( n = 25) каждые 10 дней (q10d) (n = 8) или каждые 2 недели (q2w) (n = 17) получали 162 мг TCZ. Из этих 51 пациента 26 (51%) ранее не получали TCZ, а 25 (49%) ранее получали IV TCZ и были переключены на sc TCZ в начале исследования.
Результаты исследовательской эффективности показали, что при введении тоцизолаба все параметры исследовательской эффективности улучшались у пациентов, ранее не получавших TCZ, включая показатель активности заболевания ювенильным артритом (JADAS71), и у пациентов, у которых развилась TCZ. sc TCZ были изменены, все исследовательские эффекты были сохранены, что должно было определяться в каждом случае в течение всего курса исследования и у пациентов в обеих группах массы тела (до 30 кг и ≥ 30 кг).
Было проведено описательное многоцентровое открытое однофазное исследование I фазы (NP25737) для оценки ФК, безопасности и исследовательского БП, а также эффективности тоцилизумаба у детей с sJIA (N = 11) в возрасте менее 2 лет в течение одного года. Срок 12 недель. Пациенты (находящиеся на лечении стабильными основными кортикостероидами, MTX или нестероидными противовоспалительными препаратами) получали 12 мг / кг тоцилизумаба внутривенно каждые две недели. После завершения 12-недельного лечения пациенты могли участвовать в дополнительной фазе продления (всего 52 недели или возраст до 2 лет).
Информацию о результатах безопасности см. В разделе «Нежелательные эффекты».
Результаты исследовательской эффективности показали, что тоцилизумаб улучшил средний показатель JADAS-71 у всех пациентов на протяжении всего исследования.
CRS
Эффективность Actemra в лечении CRS была исследована в ретроспективном анализе данных клинических исследований с CAR-T клеточной терапией (Tisagenlecleucel и Axicabtagen-Ciloleucel) против рака крови. Подходящих для лечения пациентов лечили тоцилизумабом с массой тела 8 мг / кг (12 мг / кг у пациентов <30 кг) с добавлением или без добавления высоких доз кортикостероидов для тяжелой или угрожающей жизни СРС; только первый эпизод CRS был рассмотрен в анализе. Коллектив для определения эффективности в когорте, получавшей Tisagenlecleucel, включал 28 мужчин и 23 женщины (всего 51 пациент) со средним возрастом 17 лет (диапазон: от 3 до 68 лет). Средняя продолжительность от начала CRS до первой дозы тоцилизумаба составляла 3 дня (диапазон: От 0 до 18 дней). CRS определяли как ремиссию, если у пациента не было лихорадки в течение по меньшей мере 24 часов и он не получал никаких вазопрессоров. Пациентов считали респондерами, когда CRS был обратимым в течение 14 дней после первой дозы тоцилизумаба, когда требовалось не более 2 доз Актемры, и не использовались никакие лекарственные средства, кроме Актемры и кортикостероидов. 39 пациентов (76,5%; 95% ДИ: 62,5% -87,2%) достигли ответа. В независимой когорте из 15 пациентов (диапазон: от 9 до 75 лет) с CRS, вызванной токсико-цилолейцелом, доля респондеров составила 53%. Пациентов считали респондерами, когда CRS был обратимым в течение 14 дней после первой дозы тоцилизумаба, когда требовалось не более 2 доз Актемры, и не использовались никакие лекарственные средства, кроме Актемры и кортикостероидов. 39 пациентов (76,5%; 95% ДИ: 62,5% -87,2%) достигли ответа. В независимой когорте из 15 пациентов (диапазон: от 9 до 75 лет) с CRS, вызванной токсико-цилолейцелом, доля респондеров составила 53%. Пациентов считали респондерами, когда CRS был обратимым в течение 14 дней после первой дозы тоцилизумаба, когда требовалось не более 2 доз Актемры, и не использовались никакие лекарственные средства, кроме Актемры и кортикостероидов. 39 пациентов (76,5%; 95% ДИ: 62,5% -87,2%) достигли ответа. В независимой когорте из 15 пациентов (диапазон: от 9 до 75 лет) с CRS, вызванной токсико-цилолейцелом, доля респондеров составила 53%.
Фармакокинетика
Тоцилизумаб ПК характеризуется нелинейной элиминацией как комбинацией линейного клиренса и элиминации с кинетикой Михаэлиса-Ментена. Нелинейная часть элиминации тоцилизумаба приводит к увеличению экспозиции, которая непропорциональна дозе. Фармакокинетические параметры тоцилизумаба не изменяются со временем. Из-за зависимости общего клиренса от концентраций тоцилизумаба в сыворотке, период полувыведения тоцилизумаба также зависит от концентрации и варьируется в зависимости от концентрации в сыворотке. Популяционный фармакокинетический анализ до сих пор не показал связи между очевидным клиренсом и наличием антител против лекарств в любой группе пациентов, протестированных до настоящего времени.
Ревматоидный артрит
Фармакокинетика у здоровых людей и у пациентов с РА предполагает, что ПК одинаков в обеих группах.
В таблице ниже приведены модельные прогнозы для вторичных параметров PK для каждого из четырех утвержденных планов доз. Популяционная фармакокинетическая (popPK) модель была разработана с набором данных анализа, состоящим из набора данных 1793 пациентов, получавших внутривенное введение, из исследований WA17822, WA17824, WA18062 и WA18063, и набора данных из 1759 пациентов, получавших внутривенное вливание и sc, из исследований WA22762 и NA25220. было. Таблица также содержит информацию о среднем значении C , поскольку в случае планов дозирования с разными временными интервалами между дозами средняя концентрация в периоде дозирования описывает сравнительное воздействие лучше, чем интегральное значение или значение AUCτ.
Таблица 5: Прогнозируемые параметры PK (среднее ± отклонение от часа) в устойчивом состоянии после в / в и после введения дозы подкожно в РА
В/В | П/К | |||
TCZ PK параметры | 4 мг / кг в сутки | 8 мг / кг в сутки | 162 мг в сутки | 162 мг в сутки |
C max (мкг / мл) | 83,8 ± 23,1 | 182 ± 50,4 | 13,2 ± 8,8 | 49,8 ± 21,0 |
C долина (мкг / мл) | 0,5 ± 1,5 | 15,9 ± 13,1 | 5,7 ± 6,8 | 43,0 ± 19,8 |
С среда (мкг / мл) | 17,8 ± 6,1 | 56,6 ± 19,3 | 10,2 ± 8,0 | 47,4 ± 20,5 |
Накопление C max | 1,01 | 1,09 | 2,12 | 5,27 |
Накопление C долина | 2,62 | 2,47 | 6,02 | 6,30 |
Накопительная среда C или AUC τ * | 1,09 | 1,32 | 2,67 | 6,32 |
* τ = 4 недели для внутривенного введения, 2 недели или 1 неделя для двух планов с подкожным введением
Конечный период полураспада приблизительно 21,5 дня был получен из оцененных параметров популяции, если в общем клиренсе тоцилизумаба преобладает линейный клиренс при высоких концентрациях в сыворотке.
В то время как максимальная концентрация (C max ) увеличивалась пропорционально дозе каждые 4 недели при дозах от 4 до 8 мг / кг в / в, средняя концентрация (C mean ) и концентрация талька (C valley ) увеличивались непропорционально дозе. В стационарном состоянии среднее значение C и CTal были выше в 3,2 и 32 раза после введения 8 мг / кг, чем после введения 4 мг / кг [74,88]. Воздействие после введения 162 мг sc qw было в 4,6 раза ( среднее значение C ) в 7,5 раз (C долина ) выше, чем после введения 162 мг sc q2w.
Коэффициенты накопления после многократных доз 4 и 8 мг / кг q4w являются низкими по сравнению с AUC и C max , но более высокими по сравнению с C Tal (2,62 и 2,47). Коэффициенты накопления после нескольких доз были выше в каждой схеме подкожного лечения, чем после внутривенного введения, с самыми высокими коэффициентами в долине С (6,02 и 6,30). Более высокое накопление по отношению к CTal было ожидаемым, учитывая влияние нелинейного клиренса при более низких концентрациях.
Что касается C max , более 90% стационарной концентрации было достигнуто после первой внутривенной инфузии, после двенадцатой подкожной инъекции как части схемы дозирования qw и после пятой подкожной инъекции как части схемы дозирования q2w. То , что AUC и C средство было обеспокоено тем , как и 90% от концентрации в стационарном состоянии после первой внутривенной инфузии 4 мг / кг , а после третьей внутривенной инфузии 8 мг / кг, а после шестой инъекции подкожно 162 мг под График дозирования q2w и после двенадцатой подкожной инъекции 162 мг достигается как часть графика дозирования qw. Что касается CTal, примерно 90% концентрации в стационарном состоянии было достигнуто после четвертой внутривенной инфузии и после шестой и двенадцатой инъекций sc соответственно.
В популяционном фармакокинетическом анализе масса тела была идентифицирована как значимая ковариабельная величина с влиянием на фармакокинетику тоцилизумаба. Поэтому люди с массой тела ≥100 кг после внутривенного введения, вероятно, будут иметь средние стационарные концентрации (в пересчете на мг / кг), которые превышают средние значения для популяции пациентов. Поэтому дозы тоцилизумаба выше 800 мг не следует назначать пациентам ≥100 кг на одну инфузию (см. «Дозировка / применение»). Из-за фиксированной дозы, используемой при введении тоцилизумаба, для этого типа применения коррекция дозы не требуется.
поглощение
После подкожного введения пациентам с РА период полувыведения составлял приблизительно 4 дня. Биодоступность для препарата SC составляет 0,8.
После подкожного введения пациентам с pJIA период полувыведения составлял приблизительно 2 дня. Биодоступность лекарственной формы sc зависит от массы тела и достигает около 100% у детей с индексом массы тела ниже 20 кг / м 2 .
После подкожного введения пациентам sJIA период полувыведения составлял приблизительно 2 дня, а биодоступность составляла 95%.
распределение
Объем распределения в стационарном состоянии составил 6,4 л у взрослых пациентов с РА, 4,01 л у пациентов с sJIA и 4,08 л у пациентов с pJIA.
метаболизм
Нет информации.
устранение
Клиренс зависит от концентрации и состоит из линейной и нелинейной части. При концентрациях> 50 мкг / мл нелинейный зазор насыщается, и зазор в основном определяется линейным зазором. Расчетный линейный клиренс составил 12,5 мл / ч у взрослых пациентов с РА, 6,7 мл / ч у пациентов с РЗА, 5,7 мл / ч и 5,8 мл / ч у педиатрических пациентов с sJIA и pJIA соответственно.
Из-за зависимости общего клиренса от концентраций тоцилизумаба в сыворотке t 1/2 тоцилизумаба зависит от концентрации и может быть рассчитан только при определенной концентрации в сыворотке.
Кажущийся t ½ тоцилизумаба, вводимого внутривенно взрослым пациентам с РА в стабильном состоянии для 8 мг / кг каждые 4 недели, составляет 13 дней.
После подкожного введения зависимое от концентрации t ½ у пациентов с РА в стабильном состоянии составляет до 13 дней для дозы подкожно 162 мг раз в неделю и 5 дней для дозы под дозой 162 мг каждые две недели. При еженедельном и двухнедельном введении 162 мг подкожно 90% устойчивого состояния достигалось после 12-й и 6-й инъекций соответственно. На основании оценок параметров популяции был определен конечный t ½ приблизительно 21,5 дней, если в общем клиренсе тоцилизумаба преобладает линейный клиренс при высоких концентрациях в сыворотке.
У детей с pJIA эффективный период полувыведения тоцилизумаба внутривенно в течение стационарного интервала дозирования в двух классах массы тела (8 мг / кг для массы тела ≥30 кг или 10 мг / кг для массы тела ниже 30 кг) составляет до 17 дней. , до 23 дней у детей с sJIA. После подкожного введения эффективный период полувыведения тоцилизумаба у пациентов с pJIA в двух классах массы тела (режим дозирования раз в две недели для массы тела ≥30 кг или режим дозирования раз в две недели для веса тела менее 30 кг) в течение интервала дозирования в стационарном состоянии составляет до 10 дней. После подкожного введения, эффективное значение составляет ½ Тоцилизумаб у пациентов с sJIA в стационарном интервале дозировки как в 162 мг один раз в неделю и в 162 мг один раз в две недели до 14 дней.
Кинетика особых групп пациентов
Дисфункция печени
Фармакокинетика тоцилизумаба у пациентов с печеночной недостаточностью не изучена.
Почечная дисфункция
Фармакокинетика тоцилизумаба у пациентов с почечной недостаточностью не изучалась.
Дети и подростки с sJIA
Фармакокинетику тоцилизумаба определяли с использованием популяционного фармакокинетического анализа базы данных из 140 пациентов с системным ювенильным артритом, либо внутривенно в дозе 8 мг / кг каждые 2 недели (пациенты с массой тела ≥30 кг), внутривенно в дозе 12 мг каждые 2 недели / кг (пациенты с массой тела менее 30 кг), подкожно еженедельно с 162 мг (пациенты с весом ≥30 кг) или каждые 10 дней или каждые 2 недели подкожно с 162 мг (пациенты с массой тела менее 30 кг).
Таблица 6: Предсказанные параметры PK (средние значения ± стандартное отклонение) в устойчивом состоянии после внутривенного или подкожного введения с sJIA
IV | Южная Каролина | |||
TCZ PK параметры | 8 мг / кг q2w | 12 мг / кг в сутки | 162 мг в | 162 мг в сутки |
C max (мкг / мл) | 256 ± 60,8 | 274 ± 63,8 | 99,8 ± 46,2 | 134 ± 58,6 |
С до (мкг / мл) | 69,7 ± 29,1 | 68,4 ± 30,0 | 79,2 ± 35,6 | 65,9 ± 31,3 |
C среднее (мкг / мл) | 119 ± 36,0 | 123 ± 36,0 | 91,3 ± 40,4 | 101 ± 43,2 |
Накопление C max | 1,42 | 1,37 | 3,66 | 1,88 |
Накопление C через | 3,20 | 3,41 | 4,39 | 3,21 |
Накопление C среднее или AUC τ * | 2,01 | 1,95 | 4,28 | 2,27 |
* τ = 2 недели для режима iv, 1 неделя и 2 недели для двух режимов sc
Приблизительно 90% устойчивого состояния было достигнуто на 8 неделе при внутривенном введении 12 мг / кг и 8 мг / кг в сутки. При подкожной обработке 162 мг, как qw, так и q2w, приблизительно 90% устойчивого состояния было достигнуто на 12 неделе.
Первичные конечные точки PK (C max , C min и AUC 2 недели ) по отношению к стационарной TCZ в этом исследовании, каждая находились в диапазоне значений, найденных в исследовании WA18221 у педиатрических пациентов в возрасте от 2 до 17 лет. масса тела <30 кг измерялась в той же схеме дозирования тоцилизумаба (12 мг / кг внутривенно каждые 2 недели).
Дети и подростки с pJIA
Фармакокинетика тоцилизумаба у пациентов с pJIA характеризовалась популяционным фармакокинетическим анализом, который включал 237 пациентов, получавших 8 мг / кг внутривенно каждые 4 недели (пациенты с массой тела ≥30 кг) или 10 мг / кг внутривенно каждые 4 недели ( Пациенты весом менее 30 кг) или 162 мг подкожно каждые 2 недели (пациенты с весом ≥30 кг) или 162 мг подкожно каждые 3 недели (пациенты с весом менее 30 кг) получали лечение.
Таблица 7: Предварительно рассчитанные параметры ПК (среднее значение ± стандартное отклонение) в устойчивом состоянии после внутривенного или подкожного введения при pJIA
В/В | П/К | |||
Параметры ПК из TCZ | 8 мг / кг каждые 4 недели | 10 мг / кг каждые 4 недели | 162 мг каждые 2 недели | 162 мг каждые 3 недели |
C max (мкг / мл) | 183 ± 42,3 | 168 ± 24,8 | 29,4 ± 13,5 | 75,5 ± 24,1 |
С до (мкг / мл) | 6,55 ± 7,93 | 1,47 ± 2,44 | 11,8 ± 7,08 | 18,4 ± 12,9 |
C среднее (мкг / мл) | 42,2 ± 13,4 | 31,6 ± 7,84 | 21,7 ± 10,4 | 45,5 ± 19,8 |
Коэффициент накопления C max | 1,04 | 1,01 | 1,72 | 1,32 |
Коэффициент накопления C корыта | 2,22 | 1,43 | 3,58 | 2,08 |
Коэффициент накопления C среднее или AUC τ * | 1,16 | 1,05 | 2,04 | 1,46 |
* τ = 4 недели для графиков внутривенного дозирования и 2 недели или 3 недели для графиков дозирования подкожно
Доклинические данные
Фармакология безопасности
На основании традиционных исследований фармакологии безопасности, токсичности многократных доз и генотоксичности, доклинические данные не выявили особой опасности для человека.
Канцерогенность / репродуктивная токсичность
Исследования канцерогенности и фертильности с тоцилизумабом не проводились, поскольку не существует подходящих моделей антител, которые не реагируют на рецепторы IL-6 грызунов.
Имеющиеся доклинические данные показали вклад IL-6 в злокачественную прогрессию и устойчивость к апоптозу различных типов опухолей и показали, что нельзя полностью исключать соответствующий риск возникновения опухоли и / или роста опухоли с помощью терапии тоцилизумабом. В 6-месячном исследовании токсичности с макаками-резусами или с мышами, нокаутированными по IL-6, пролиферативных поражений обнаружено не было.
Имеющиеся доклинические данные свидетельствуют о том, что терапия тоцилизумабом не влияет на фертильность. В исследовании токсичности у макак-резус не наблюдалось влияния на эндокринную активность или органы репродуктивной системы. На репродуктивную функцию не влияли мыши, которые не экспрессировали IL-6.
Если во время ранней беременности тоцилизумаб назначается макакам-резусам, прямого или косвенного вредного воздействия на беременность или развитие эмбриона и плода обнаружено не было. Тем не менее, небольшое увеличение числа абортов / гибели эмбриона и плода наблюдалось при высоких системных концентрациях (более чем в 100 раз выше, чем у людей) при кумулятивной дозе 50 мг / кг массы тела по сравнению с плацебо или более низкими дозами. Хотя IL-6, по-видимому, не играет критической роли в росте плода или в иммунологическом контроле взаимодействия между матерью и плодом, нельзя исключать взаимодействие с тоцилизумабом.
У кормящих мышей экскреция с грудным молоком была обнаружена после однократного внутривенного введения суррогатного антитела мышиного тоцилизумаба.
Лечение ювенильных мышей мышиным аналогом не вызывало токсичности, особенно отсутствие нарушения роста скелета, иммунных функций и полового созревания. Неклинический профиль безопасности тоцилизумаба у обезьян cynomolgus не предполагает разницы между внутривенным и подкожным введением.
Дополнительные данные (местная токсичность, фототоксичность, иммунотоксичность)
Доклинические испытания комбинации тоцилизумаб / метотрексат не проводились.
Другие уведомления
несовместимость
Внутривенная лекарственная форма:
За исключением 0,9% раствора хлорида натрия, указанного в «Инструкции по обращению», Актемру нельзя смешивать с другими лекарственными средствами. Не было никаких несовместимостей между Actemra и инфузионными пакетами или системами, изготовленными из поливинилхлорида, полиэтилена или полипропилена.
Подкожная лекарственная форма:
Актемру нельзя смешивать с другими лекарственными средствами.
долговечность
Лекарственное средство следует применять только до даты, обозначенной на упаковке «EXP».
Срок годности после вскрытия
Внутривенное управление
После разбавления в 0,9% (мас. / Об.) Растворе хлорида натрия была продемонстрирована химическая и физическая стабильность при использовании в течение 24 часов при 30 ° C для инфузионного раствора.
Поскольку разбавленный раствор для инфузии не содержит консервантов, готовый инфузионный раствор следует использовать немедленно с микробиологической точки зрения. Если он не может быть введен непосредственно, за периоды использования и условия хранения несет ответственность пользователь, и обычно он не должен превышать 24 часа при 2-8 ° C, если только разбавление не проводилось в контролируемых и утвержденных асептических условиях.
Подкожное введение
Перед использованием предварительно заполненный шприц и предварительно заполненную ручку следует извлечь из холодильника и предварительно заполненного шприца не менее чем через 25-30 минут, а предварительно заполненную ручку - не менее чем через 45 минут вне коробки при комнатной температуре (15-25 ° C). Не хранить при температуре выше 30 ° С. После извлечения из холодильника раствор для инъекций следует вводить в течение 8 часов.
Специальные инструкции по хранению
Внутривенное управление
Хранить концентрат в холодильнике (2-8 ° С).
Не замерзай.
Храните контейнер во внешней коробке, чтобы защитить содержимое от света.
Подкожное введение
Храните предварительно заполненный шприц и предварительно заполненную ручку в холодильнике при 2-8 ° C. Не замерзай. Хранить во внешней коробке для защиты содержимого от света.
Инструкция по обращению
Внутривенное управление
Актемра поставляется в апирогенном флаконе для одноразового использования без консервантов.
- Извлечь необходимый объем Актемры из одного или нескольких неиспользованных флаконов в асептических условиях, используя отдельный неиспользованный шприц (доза 8 мг / кг массы тела соответствует 0,4 мл / кг массы тела, 10 мг / кг соответствует 0,5 мл / кг, 12 мг / кг соответствует 0,6 мл / кг). Оставшиеся лекарства во флаконе следует выбросить.
- С другим неиспользованным шприцем отбросьте тот же объем изотонического раствора хлорида натрия (стерильный, апирогенный 0,9% (вес / объем) раствор хлорида натрия), что и необходимый объем Актемры, из инфузионного пакета объемом 100 мл (для пациентов ≥30 кг) или из инфузионного пакета объемом 50 мл ( для пациентов с pJIA или sJIA <30 кг)
- В асептических условиях добавьте объем Актемры, который вы вынули, в пакет для инфузий объемом 100 или 50 мл, упомянутый выше. Препарат теперь содержит необходимое количество Актемры в общем объеме 100 мл или 50 мл 0,9% раствора хлорида натрия.
- Чтобы смешать раствор, аккуратно переверните пакет для инфузии вверх дном, чтобы избежать пенообразования.
- Парентеральные препараты должны быть проверены на предмет частиц или обесцвечивания перед использованием.
Только инфузионные растворы могут быть прозрачными или опалесцирующими, бесцветными или светло-желтыми и не содержат плавающих частиц. - Любые неиспользованные остатки лекарств (концентрат и разбавленный инфузионный раствор) следует утилизировать и утилизировать в соответствии с применимыми правилами.
Откажитесь от неиспользованных или просроченных лекарств
Выпуск фармацевтических препаратов в окружающую среду должен быть сведен к минимуму. Лекарства не следует утилизировать через сточные воды, а бытовые отходы следует избегать. После завершения терапии или истечения срока годности неиспользованные лекарственные средства должны быть возвращены в оригинальной упаковке в пункт доставки (врач или фармацевт) для надлежащей утилизации.
Подкожное введение
На вкладыше в упаковку (информация о пациенте) содержатся подробные инструкции по использованию предварительно заполненного шприца или предварительно заполненной ручки.
Не используйте, если раствор мутный, содержит частицы или обесцвечен (то есть не бесцветный или желтоватый) или если какая-либо часть предварительно заполненного шприца, предохранительного устройства иглы или предварительно заполненной ручки кажется поврежденной.
Предварительно заполненный шприц:
После снятия колпачка иглы шприц следует использовать немедленно (не более 5 минут).
Предварительно заполненная ручка:
Предварительно заполненную ручку не следует трясти. После снятия защитного колпачка инъекция должна быть начата в течение 3 минут .
Если фиолетовый индикатор не перемещается после нажатия кнопки запуска, предварительно заполненное перо следует выбросить. Не следует пытаться повторно использовать предварительно заполненную ручку.
Утилизация материала
Пациентам следует учитывать, что при использовании и утилизации предварительно заполненного шприца и предохранительного устройства для иглы, а также предварительно заполненной ручки необходимо строго соблюдать следующие пункты:
- Предварительно заполненные шприцы и предварительно заполненные ручки не должны использоваться повторно.
- Все использованные предварительно заполненные шприцы и предварительно заполненные ручки должны быть выброшены в контейнер для утилизации шприца (устойчивый к проколу одноразовый контейнер).
- Храните контейнеры в недоступном для детей месте.
- Не выбрасывайте использованные контейнеры для шприцев вместе с бытовыми отходами, но в соответствии с инструкциями вашего врача или фармацевта.
Для использования в домашних условиях пациенты должны предоставить защищенный от проколов контейнер для утилизации использованных предварительно заполненных шприцев и предварительно заполненных ручек.
Номер одобрения
58868, 63166, 66931 (Swissmedic).
Владелец маркетинговой авторизации
Roche Pharma (Швейцария) AG, Базель.
Отзывов (0)
Похожие товары

Бесплатная консультация опытного специалиста
Опишите симптомы или нужный препарат – мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой на дом или просто проконсультируем.
Нас 14 специалистов и 0 ботов. Мы всегда будем с вами на связи и сможем связаться в любое время.